
Методичні рекомендації по проведенню досліду №2
|
|
1. Закріпити віскозиметр (піпетку) вертикально. Заповнити його дистильованою водою на певний об’єм. Після цього дайте воді можливість повільно витікати з віскозиметру (піпетки), відраховуючи час витікання води за секундоміром.
2. Дослід повторити три рази і взяти для обчислень середнє значення часу витікання води ( 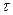 о) в секундах.
о) в секундах.
3. Аналогічно провести визначення часу витікання гліцерину з віскозиметру (об’єм води та гліцерину однакові). Дослід повторити три рази і взят для обчислень середнє значення ( 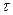 ) в секундах.
) в секундах.
4. Експериментально визначені дані часу витікання води і гліцерину занести в таблицю результатів:
| № п/п | Назва рідини | Густина, 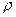 , г/см3 , г/см3
| Час витікання | В’язкість,  , Па ´ с , Па ´ с
| |||
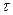 1 1
| 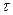 2 2
| 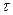 3 3
| 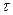 ср. ср.
| ||||
| 1. | Вода | ||||||
| 2. | Гліцерин |
5. Значення густин води і гліцерину, в’язкості води за певної температури взяти з таблиці 2 (див. додаток) та записати в таблицю результатів.
6. В’язкість гліцерину обчислити за формулою 2:
 (2),
(2),
де  ‑ відносна в’язкість гліцерину;
‑ відносна в’язкість гліцерину;
 о – в’язкість води;
о – в’язкість води;
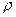 - густина гліцерину, г/см3;
- густина гліцерину, г/см3;
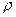 о – густина води, г/см3;
о – густина води, г/см3;
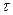 о – час витікання води, сек.;
о – час витікання води, сек.;
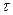 ‑ час витікання гліцерину, сек.
‑ час витікання гліцерину, сек.
 =
=
7.Одержані результати відносної в’язкості гліцерину внести в таблицю результатів.
8.Зробити висновок про величину в’язкості гліцерину порівняно з в’язкістю води. Обов’язково вкажіть одержані результати.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Зробити загальний висновок по роботі.
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Додаток
Таблиця 1.Значення густин води та етанолу, поверхневого натягу води за різних температур
| Температура, оС | Густина води, г/см3 |  води, Н/м води, Н/м
| Густина етанолу, г/см3 |
| 0,9997 | 74,20∙10-3 | 0,7978 | |
| 0,9990 | 73,48∙10-3 | 0,7936 | |
| 0,9980 | 72,75∙10-3 | 0,7894 | |
| 0,9970 | 71,96∙10-3 | 0,7852 |
Таблиця 2. Значення густин води, гліцерину, в’язкості води за різних температур
| Температура, оС | Густина води, г/см3 | Густина гліцерину, г/см3 | В’язкість води, Па ´ с |
| 0,9997 | 1,2594 | 1,3077∙10-3 | |
| 0,9990 | 1,1404∙10-3 | ||
| 0,9980 | 1,0050∙10-3 | ||
| 0,9970 | 0,8937∙10-3 |
Лабораторна робота №2
Тема: Вивчення впливу різних факторів на швидкість хімічних реакцій та зміщення стану хімічної рівноваги
Мета:
ü дослідження залежності швидкості хімічної реакції від концентрації, температури, площі поверхні стикання регентів, наявності каталізатора;
ü дослідження впливу зміни концентрації реагентів і продуктів на зміщення стану хімічної рівноваги;
ü удосконалення умінь і навичок проведення хімічного експерименту;
ü формування умінь інтерпретації результатів хімічного експерименту (спостереження, висновки).
Забезпечення:
Обладнання: стакани місткістю 50мл, термометр, водна баня, градуйовані піпетки, штатив з пробірками, секундомір,.
Реактиви: 0,1Н розчин тіосульфату натрію, 0,1М сульфатна кислота, дистильована вода, гранули цинку, розведена хлоридна кислота, розчин хлориду феруму(ІІІ), розчин роданіду калію, кристалічні хлорид феруму і роданід калію, 10% розчин пероксиду водню, діоксид марганцю.
Хід роботи
Дослід №1. Залежність швидкості реакції від концентрації реагентів
Теоретичні положення
Швидкість хімічної реакції – це число елементарних актів взаємодії за одиницю часу в одиниці об’єму (для гомогенних реакцій) або на одиниці поверхні поділу фаз (для гетерогенних реакцій).
Швидкість реакції визначається зміною концентрації будь-якої з вихідних речовин або кінцевих продуктів.
υ =  або υ =
або υ =  ,
,
де ∆v - зміна кількості речовини, моль
∆t – зміна часу, сек. V – об’єм, см3 або л
Одиниці вимірювання швидкості реакції: моль/(л∙сек), або моль/(м3∙сек).
Якщо V = 1л, то ν = С (молярна концентрація – число моль речовини в 1л розчину), тобто
υ =  ,
,
де υ – середня швидкість реакції у даний проміжок часу в ізобарно-ізотермічних умовах.
Швидкість реакції залежить від:
þ природи реагуючих речовин;
þ доступності реагентів (ступінь подрібнення твердих реагентів, площа поверхні стикання реагентів);
þ концентрації реагентів;
þ температури;
þ наявності каталізатора.
Ознака реакції ‑ утворення жовтуватої каламуті (нерозчинна сірка). Тіосульфатна кислота нестійка, тому її отримують взаємодією тіосульфату натрію з розбавленою сірчаною кислотою:
Na2S2O3 + H2SO4 = H2S2O3 + Na2SO4
H2S2O3 = S↓ + H2O + SO2
Сумарна реакція: Na2S2O3 + H2SO4 = S↓ + SO2 + H2O + Na2SO4
Хід виконання досліду: у три стакани налити 0,1Н розчин тіосульфату натрію у таких співвідношеннях: у першу – 5мл тіосульфату натрію і 10мл води; у другу – 10мл тіосульфату натрію і 5 мл води; у третю – 15мл тіосульфату натрію.
У кожний стакан налити по 5мл 0,1М розчину сульфатної кислоти, відмічаючи час помутніння розчину за секундоміром. Кінцем реакції слід вважати однакову інтенсивність каламуті. Результати експерименту занести в таблицю.
| № досліду | Об’єм, мл | Час, с | Швидкість реакції
 , с-1 , с-1
| ||
| 0,1Н Na2S2O3 | Н2О | 0,1М Н2SO4 | |||
| 1. | |||||
| 2. | |||||
| 3. | - |
Зробити висновок. ________________________________________________________
______________________________________________________________________________
______________________________________________________________________________
Дослід №2. Залежність швидкості реакції від температури
Хід виконання досліду: у три великі пробірки налити по 5 мл 0,1Н розчину тіосульфату натрію. У першу пробірку добавити 5 мл 0,1М розчину сульфатної кислоти, струсити (температура кімнатна). Відмітити за секундоміром час до появи каламуті.
У другу пробірку налити 5 мл розчину тіосульфату натрію і 5 мл 0,1М розчину сульфатної кислоти. Нагріти пробірку на 100 вище за кімнатну температуру. Відмітити час появи каламуті.
Дослід повторити, нагріваючи розчин на 100С вище температури у другому випадку.
| № досліду | Об’єм, мл | Температура досліду, t0C | Швидкість реакції
 , с-1 , с-1
| |
| 0,1Н Na2S2O3 | 0,1М Н2SO4 | |||
| 1. | ||||
| 2. | ||||
| 3. |
Зробити висновок. ________________________________________________________
______________________________________________________________________________
______________________________________________________________________________
Дослід №3. Залежність швидкості реакції від площі поверхні стикання реагентів
Теоретичні положення
Швидкість гетерогенних реакцій залежить від:
S концентрації рідкої або газоподібної речовини;
S величини поверхні S твердих реагентів (збільшення S↑ призводить до υ↑, досягається подрібненням);
S дифузії (надходження до поверхні твердого реагенту нових порцій реагуючих речовин) – прискорюють струшуванням і перемішуванням.
Проводяться за однакових умов дві однакові реакції взаємодії цинку з кислотою.
Хімічна сутність:
Zn + 2HCI → ZnCI2 + H2↑
Ознака реакції: розчинення гранули цинку і виділення бульбашок водню (об’єм водню вимірюється протягом реакції). Швидкість виділення водню при проходженні реакцій з кислотою гранули цинку і розплющеного цинку буде різною тому, що різний ступінь подрібнення реагенту.
Хід виконання досліду: Переглянути відеозапис експерименту. У дві пробірки покласти: в одну – 1-2гранули цинку, у другу – розплющений цинк. Добавити кислоту в обидві пробірки. У якій з пробірок швидше відбувається реакція? ______________________________________________________________________________
Зробити висновок. ________________________________________________________
______________________________________________________________________________
______________________________________________________________________________
Дослід №4. Вплив каталізатора на швидкість реакції
Теоретичні положення
Каталізатор – це речовина, що прискорює швидкість реакції, бере участь у її проміжних стадіях, але кількісно і якісно при цьому не змінюється.
Основна роль каталізатора – утворення з реагентом проміжних реакційно здатних сполук, які легко розкладаються на продукти реакції.
Каталізатор прискорює перебіг реакції:
Ø створюючи умови для нового шляху реакції (забезпечення енергією, необхідною для дисоціації реагенту, знижується Еа – приклад: Н2 + О2 на поверхні Pt);
Ø сприяє упорядкуванню реагентів у активованому комплексі (збільшується ймовірність необхідної орієнтації реагентів для їхньої взаємодії – приклад: реакція водню з йодом).
Каталізатор бере хімічну участь у реакції: витрачається на одній стадії та регенерується на іншій.
Хід виконання досліду:
У пробірку налити розчин пероксиду водню, насипати на кінчику шпателя порошок оксиду мангану (ІV). Описати спостереження ______________________________________
______________________________________________________________________________
Як перевірити проходження реакції та утворення кисню? _______________________
______________________________________________________________________________
Яку роль відіграє оксид мангану (ІV)? _______________________________________
Зробити висновок. ________________________________________________________
______________________________________________________________________________
Дослід 5. Вплив зміни концентрацій реагентів і продуктів на зміщення хімічної рівноваги
Теоретичні положення
Перехід системи від одного стану рівноваги до іншого – зміщення хімічної рівноваги.
Принцип Ле Шательє (1884): якщо на систему, що перебуває в стані рівноваги, впливати ззовні, то рівновага зміщується у бік тієї реакції, що послаблює цей вплив.
|
© 2013 wikipage.com.ua - Дякуємо за посилання на wikipage.com.ua | Контакти |