
Методи дослідження металів: структурні і фізичні
|
|
Метали і сплави мають різноманітні властивості. Використовуючи один метод дослідження металів, неможливо отримати інформацію про всі властивості. Використовують декілька методів аналізу.
3.4. Визначення хімічного складу
Використовуються методи кількісного аналізу.
1. Якщо не вимагається великої точності, то використовують спектральний аналіз.
Спектральний аналіз заснований на розкладанні і дослідженні спектру електричної дуги або іскри, що штучно порушується між мідним електродом і досліджуваним металом.
Запалюється дуга, промінь світла через призми потрапляє в окуляр для аналізу спектру. Колір і концентрація ліній спектру дозволяють визначити вміст хімічних елементів.
Використовуються стаціонарні і переносні спектроскопи.
2. Точніші відомості про склад дає рентгеноспектральний аналіз.
Проводиться на мікроаналізаторах. Дозволяє визначити склад фаз сплаву, характеристики дифузійної рухливості атомів.
3.5. Вивчення структури
Розрізняють макроструктуру, мікроструктуру і тонку структуру.
1. Макроструктурний аналіз – вивчення будови металів і сплавів неозброєним оком або за умов невеликого збільшення за допомогою лупи.
Здійснюється після попередньої підготовки досліджуваної поверхні (шліфування і травленням спеціальними реактивами).
Дозволяє виявити і визначити дефекти, що виникли на різних етапах виробництва литих, кованих, штампованих і катаних заготовок, а також причини руйнування деталей.
Встановлюють: вид зламу (в'язкий, крихкий); величину, форму і розташування зерен і дендритів литого металу; дефекти, що порушують суцільність металу (усадкову пористість, газові пухирці, раковини, тріщини); хімічну неоднорідність металу, викликану процесами кристалізації або створену термічною і хіміко-термічною обробкою; волокна в деформованому металі.
2. Мікроструктурний аналіз – вивчення поверхні за допомогою світлових мікроскопів. Збільшення – 50–2000 разів. Дозволяє виявити елементи структури розміром до 0,2 мкм.
Зразки – мікрошліфи з блискучою полірованою поверхнею, оскільки структура розглядається у відбитому світлі. Спостерігають за мікротріщинами і неметалевими включеннями.
Для виявлення мікроструктури поверхню протравлюють реактивами, що залежать від складу сплаву. Різні фази протравлюються неоднаково і забарвлюються по-різному. Можна виявити форму, розміри й орієнтування зерен, окремі фази і структурні складові.
Окрім світлових мікроскопів використовують електронні мікроскопи з великою роздільною здатністю.
Зображення формується за допомогою швидкого потоку електронів. Електронні промені з довжиною хвилі (0,04–0,12) ·108 см дають можливість розрізняти деталі об'єкту, що за своїми розмірами відповідають міжатомним відстаням.
Растрові мікроскопи. Зображення створюється за рахунок вторинної емісії електронів, що випромінюються поверхнею, на яку падає потік первинних електронів, що безперервно переміщається по цій поверхні. Вивчається безпосередньо поверхня металу. Роздільна здатність дещо нижче, ніж у мікроскопів, що просвічують.
3. Для вивчення атомно-кристалічної будови твердих тіл (тонка будова) використовуються рентгенографічні методи, що дозволяють встановлювати зв'язок між хімічним складом, структурою і властивостями тіла, тип твердих розчинів, мікронапруги, концентрацію дефектів, щільність дислокацій.
3.6. Фізичні методи дослідження
1. Термічний аналіззаснований на явищі теплового ефекту. Фазові перетворення в сплавах супроводжуються тепловим ефектом, у результаті на кривих охолодження сплавів за температур фазових перетворень спостерігаються точки перегину, або температурні зупинки. Даний метод дозволяє визначити критичні точки.
2. Дилатометричний метод.
У процесі нагрівання металів і сплавів відбувається зміна об'єму і лінійних розмірів – теплове розширення. Якщо зміни обумовлені тільки збільшенням енерґії коливань атомів, то під час охолодження розміри відновлюються. За фазових перетворень зміни розмірів є незворотними.
Метод дозволяє визначити критичні точки сплавів, температурні інтервали існування фаз, а також вивчати процеси розпаду твердих розчинів.
Розділ 4. Загальна теорія сплавів.
Будова, кристалізація і властивості сплавів. Діаграма стану
4.1. Поняття про сплави і методи їх отримання
Під сплавом розуміють речовину, отриману сплавом двох або більше елементів. Існують й інші способи виготовлення сплавів: спікання, електроліз, сублімація. В цьому випадку речовини називаються псевдосплавами.
Сплав, виготовлений переважно з металевих елементів і який має металеві властивості, називається металевим сплавом. Сплави мають комплекс різних властивостей, що змінюються залежно від складу і методу обробки.
Основні поняття в теорії сплавів
Система – група тіл, що виділяються для спостереження і вивчення.
У металознавстві системами є метали і металеві сплави. Чистий метал є простою однокомпонентною системою, сплав – складною системою, що складається з двох і більше компонентів.
Компоненти – речовини, що утворюють систему. Як компоненти виступають чисті речовини і хімічні сполуки, якщо вони не дисоціюють на складові частини в досліджуваному інтервалі температур.
Фаза – однорідна частина системи, відокремлена від інших частин системи поверхнею розділу, під час переходу через яку структура і властивості різко змінюються.
Варіантність (C) (міра вільності) – це число внутрішніх і зовнішніх чинників (температура, тиск, концентрація), які можна змінювати без зміни кількості фаз у системі.
Якщо варіантність C = 1 (моноваріантна система), то можлива зміна одного з чинників у деяких межах без зміни числа фаз.
Якщо варіантність C= 0 (нонваріантна система), то зовнішні чинники змінювати не можна без зміни числа фаз у системі.
Існує математичний зв'язок між числом компонентів (К), числом фаз (Ф) і варіантністю системи (С).
Це правило фаз,або закон Гіббса:
С = К – Ф +2.
Якщо прийняти, що всі перетворення відбуваються за постійного тиску, то число змінних зменшиться:
С = К – Ф +1,
де С – варіантність системи,
К – число компонентів,
Ф – число фаз,
1 – враховує можливість зміни температури.
4.2. Особливості будови, кристалізації і властивостей сплавів: механічних сумішей, твердих розчинів, хімічних сполук
Будова металевого сплаву залежить від того, в які взаємодії вступають компоненти, складові сплаву. Майже всі метали в рідкому стані розчиняються один в одному в будь-яких співвідношеннях.
У процесі утворення сплавів під час їх твердіння можлива різна взаємодія компонентів.
Залежно від характеру взаємодії компонентів, розрізняють сплави:
1) механічні суміші,
2) хімічні сполуки,
3) тверді розчини.
Сплави механічні суміші утворюються, коли компоненти взаємно не розчиняються в твердому стані і не вступають у хімічну реакцію з утворенням з'єднання.
Утворюються механічні суміші між елементами, що значно розрізняються за будовою і властивостями, коли сила взаємодії між однорідними атомами більша, ніж між різнорідними. Сплав складається з кристалів компонентів, що входять до його складу (рис. 4.1). У сплавах зберігаються кристалічні решітки компонентів.
|

Рис. 4.1. Схема мікроструктури механічної суміші
Сплави хімічні сполуки утворюються між елементами, що значно розрізняються за будовою і властивостями, якщо сила взаємодії між різнорідними атомами більша, ніж між однорідними.
Особливості цих сплавів:
1. Постійність складу, тобто сплав утворюється за певного співвідношення компонентів; хімічна сполука позначається Аn Вm.
2. Утворюється специфічна кристалічна решітка з правильним впорядкованим розташуванням атомів, що відрізняється від ґрат елементів, з яких складаються хімічні сполуки (рис. 4.2).
3. Яскраво виражені індивідуальні властивості.
4. Постійність температури кристалізації, як у чистих компонентів.

Рис. 4.2. Кристалічна решітка хімічної сполуки
Сплави тверді розчини – це тверді фази, в яких співвідношення між компонентами можуть змінюватися; вони є кристалічними речовинами.
Характерною особливістю твердих розчинів є наявність в їх кристалічній решітці різнорідних атомів за збереження типу ґрат розчинника.
Твердий розчин складається з однорідних зерен (рис. 4.3).

Рис. 4.3. Схема мікроструктури твердого розчину
4.3. Класифікація сплавів твердих розчинів
За ступенями розчинності компонентів розрізняють тверді розчини:
· з необмеженою розчинністю компонентів,
· з обмеженою розчинністю компонентів.
За необмеженої розчинності компонентів кристалічна решітка компоненту-розчинника у міру збільшення концентрації розчиненого компоненту плавно переходить у кристалічну решітку розчиненого компоненту.
Для утворення розчинів із необмеженою розчинністю необхідні:
1. Ізоморфність (однотипність) кристалічних решіток компонентів;
2. Близькість атомних радіусів компонентів, які не повинні відрізнятися більше ніж на 8–13 %.
3. Близькість фізико-хімічних властивостей подібних за будовою валентних оболонок атомів.
За обмеженої розчинності компонентів можлива концентрація розчиненої речовини до певної межі. За подальшого збільшення концентрації однорідний твердий розчин розпадається з утворенням двофазної суміші.
За характером розподілу атомів розчиненої речовини в кристалічній решітці розчинника розрізняють тверді розчини:
· заміщення,
· занурення,
· віднімання.
У розчинах заміщення в кристалічній решітці розчинника частина його атомів заміщена атомами розчиненого елементу (рис. 4.4 а). Заміщення здійснюється у випадкових місцях, тому такі розчини називають неврегульованими твердими розчинами.
У процесі утворення розчинів заміщення періоди ґрат змінюються залежно від різниці атомних діаметрів розчиненого елементу і розчинника. Якщо атом розчиненого елементу більше атома розчинника, то елементарні осередки збільшуються, якщо менше – скорочуються. У першому наближенні, ця зміна пропорційна концентрації розчиненого компоненту. Зміна параметрів ґрат під час утворення твердих розчинів – важливий момент, що визначає зміну властивостей. Зменшення параметру веде до більшого зміцнення, ніж його збільшення.

а) б)
Рис. 4.4. Кристалічна решітка твердих розчинів
заміщення (а), занурення (б)
Тверді розчини занурення утворюються зануренням атомів розчиненого компоненту в пори кристалічної решітки розчинника (рис. 4.4 б).
Утворення таких розчинів можливо, якщо атоми розчиненого елементу мають малі розміри. Такими є елементи, що знаходяться на початку періодичної системи Д. І. Менделєєва, – вуглець, водень, азот, бор. Розміри атомів перевищують розміри міжатомних проміжків у кристалічній решітці металу, що викликає спотворення ґрат і в них виникає напруга. Концентрація таких розчинів не перевищує 2–2,5 %.
Тверді розчини віднімання (або розчини з дефектними ґратами) утворюються на базі хімічних сполук. Можливою є не тільки заміна одних атомів у вузлах кристалічної решітки іншими, але й утворення порожніх, не зайнятих атомами, вузлів у ґратах.
До хімічної сполуки додають один з елементів, що входить до формули; його атоми займають нормальне положення в ґратах з'єднання, а місця атомів іншого елементу залишаються незайнятими.
Кристалізація сплавів
Кристалізація сплавів підпорядкована тим же закономірностям, що і кристалізація чистих металів. Необхідною умовою є прагнення системи до стану з мінімумом вільної енерґії.
Основною відмінністю є велика роль дифузійних процесів між рідиною і фазою, що кристалізується. Ці процеси необхідні для перерозподілу різнорідних атомів, рівномірно розподілених у рідкій фазі.
У сплавах у твердих станах мають місце процеси перекристалізації, зумовлені алотропічними перетвореннями компонентів сплаву, розпадом твердих розчинів, виділенням із твердих розчинів вторинних фаз, коли розчинність компонентів у твердому стані міняється зі зміною температури.
За перекристалізації в твердому стані утворюються центри кристалізації і відбувається їх зростання.
Зазвичай центри кристалізації виникають по межах зерен старої фази, де ґрати мають найбільш дефектну будову і де є домішки, які можуть стати центрами нових кристалів. У старої і нової фази протягом деякого часу є загальні площини. Такий зв'язок ґрат називається когерентним зв'язком. У разі відмінності будови старої і нової фаз перетворення протікає з утворенням проміжних фаз.
Порушення когерентності і відособлення кристалів настає, коли вони отримують певні розміри. Процеси кристалізації сплавів вивчаються за діаграмами стану.
Діаграма стану є графічним зображенням стану будь-якого сплаву системи, що вивчається, залежно від концентрації і температури (рис. 4.5).
|

Рис. 4.5. Діаграма стану
Діаграми стану показують стійкі стани, тобто стани, які за даних умов володіють мінімумом вільної енерґії, і тому її також називають діаграмою рівноваги, оскільки вона показує, які за даних умов існують рівноважні фази.
У результаті отримують серію кривих охолоджування, на яких за температур фазових перетворень спостерігаються точки перегину і температурні зупинки.
Температури, що відповідають фазовим перетворенням, називають критичними точками. Деякі критичні точки мають назви, наприклад, точку, що відповідає початку кристалізації, називають точкою ліквідус, а кінцю кристалізації – точка солідус.
За кривими охолодження будують діаграму стану в координатах: за віссю абсцис – концентрація компонентів, за віссю ординат – температура.
Шкала концентрацій показує вміст компоненту В. Основнимилініями є лінії ліквідус (1) і солідус (2), а також лінії, що відповідають фазовим перетворенням у твердому стані (3, 4).
За діаграмою стану можна визначити температури фазових перетворень, зміну фазового складу, приблизно, властивості сплаву, види обробки, які можна застосовувати для даного сплаву.
Розділ 5. Механічні та експлуатаційні властивості металів
5.1. Механічні властивості і способи визначення їх кількісних характеристик: твердість, в'язкість, втомна міцність
Твердість – це властивість матеріалу чинити опір проникненню в його поверхню стандартного тіла (індентора), що не деформується при випробуванні.
Широке розповсюдження пояснюється тим, що не потрібні спеціальні зразки.
Це неруйнівний метод контролю. Основний метод оцінки якості термічної обробки виробу. Твердість визначають або за глибиною проникнення індентора (метод Роквелла), або за величиною відбитку від втискання (методи Брінелля, Віккерса, мікротвердості).
Відбувається пластична деформація матеріалу. Чим більше опір матеріалу пластичній деформації, тим вища твердість.
Найбільшого поширення набули методи Брінелля, Роквелла, Віккерса і мікротвердості.
Схеми випробувань представлені на рис. 5.1.
 | |||
 | |||

a) б) в)
Рис. 5.1. Схеми визначення твердості:
а – за Брінеллем; б – за Роквеллом; в – за Віккерсом
Твердість за Брінеллем ( ГОСТ 9012)
Випробування проводять на твердомірі Брінелля (рис. 5.1 а).
Як індентор використовується сталева загартована кулька діаметром D 2,5; 5; 10 мм, залежно від товщини виробу.
Навантаження Р, залежно від діаметру кульки і вимірюваної твердості: для термічно обробленої сталі і чавуну –  , литої бронзи і латуні –
, литої бронзи і латуні –  , алюмінію й інших дуже м'яких металів –
, алюмінію й інших дуже м'яких металів –  .
.
Тривалість витримки τ: для сталі і чавуну – 10 с, для латуні і бронзи – 30 с.
Отриманий відбиток вимірюється в двох напрямах за допомогою лупи Брінелля.
Твердість визначається як відношення прикладеного навантаження Р до сферичної поверхні відбитку F:
 .
.
Стандартними умовами є: D = 10 мм; Р = 3000 кгс; τ = 10 с.
У цьому випадку твердість за Брінеллем позначається НВ 250, в інших випадках вказуються умови: НВ D / P /τ /, НВ 5/ 250 /30 – 80.
Метод Роквелла (ГОСТ 9013)
Заснований на втисканні в поверхню наконечника під певним навантаженням (рис. 5.1 б).
Індентор для м'яких матеріалів (до НВ 230) – сталева кулька діаметром 1/16” (Ø1,6 мм), для твердіших матеріалів – алмазний конус.
Навантаження здійснюється в два етапи.
Спочатку прикладається попереднє навантаження Po (10 кгс) для щільного контакту наконечника зі зразком.
Потім прикладається основне навантаження Р1, потягом деякого часу діє загальне робоче навантаження Р.
Після зняття основного навантаження визначають значення твердості за глибиною залишкового втискання наконечника h під навантаженням Po.
Залежно від природи матеріалу використовують три шкали твердості (табл. 5.1).
Таблиця 5.1. Шкали для визначення твердості за Роквеллом
| Шкала | Позначення | Індентор | Навантаження, кг | Застосування | ||
| Ро | Р1 | Р2 | ||||
| А | HRA | Алмазний конус | Для особливо твердих матеріалів | |||
| В | HRВ | Сталева кулька Ø1/16" | Для відносно м’яких матеріалів | |||
| С | HRС | Алмазний конус | Для відносно твердих матеріалів |
Метод Віккерса
Твердість визначається за величиною відбитку (рис. 5.1 в).
Як індентор використовується алмазна чотиригранна піраміда з кутом при вершині 136o.
Твердість розраховується як відношення прикладеного навантаження P до площі поверхні відбитку F:

Навантаження Р складає 5–100 кгс. Діагональ відбитку d вимірюється за допомогою мікроскопу, встановленого на приладі.
Перевага даного способу в тому, що можна вимірювати твердість будь-яких матеріалів (тонкі вироби, поверхні кульок), висока точність і чутливість методу.
Спосіб мікротвердості застосовується для визначення твердості окремих структурних складових і фаз сплаву, дуже тонких поверхневих шарів (соті долі міліметра).
Аналогічний способу Віккерса. Індентор – піраміда менших розмірів, навантаження під час втискання Р становить 5–500 гс.
 .
.
Динамічний метод (за Шором)
Кульку кидають на поверхню із заданої висоти, вона відскакує на певну величину. Чим більше величина відскоку, тим твердіше матеріал.
У результаті проведення динамічних випробувань на ударний вигин спеціальних зразків із надрізом (ГОСТ 9454) оцінюється в'язкість матеріалів і встановлюється їх схильність до переходу з в'язкого стану в крихкий.
В'язкість – здатність матеріалу поглинати механічну енерґію зовнішніх сил за рахунок пластичної деформації.
Є енерґетичною характеристикою матеріалу, виражається в одиницях роботи. В'язкість металів і сплавів визначається їх хімічним складом, термічною обробкою й іншими внутрішніми чинниками.
Також в'язкість залежить від умов, у яких працює метал (температури, швидкості навантаження, наявність концентраторів напруги).
Вплив температури
Із підвищенням температури в'язкість збільшується (рис. 5.2).
Межа текучості Sт істотно змінюється зі зміною температури, а опір відриву Sот не залежить від температури. Затемператури вище Тв межа текучості менша опору відриву. Якщо за навантаження спочатку має місце пластична деформація, а потім – руйнування, метал знаходиться у в'язкому стані.
За температури нижче Тн опір відриву менший межі текучості. В цьому випадку метал руйнується без попередньої деформації, тобто знаходиться в крихкому стані. Перехід із в'язкого стану в крихкий відбувається в інтервалі температур Тн –Тв.
Холодокрихкістю називається схильність металу до переходу в крихкий стан зі зниженням температури.
Холодокрихкими є залізо, вольфрам, цинк й інші метали, об’ємноцентровані, що мають, кубічну і гексагональну щільноупаковану кристалічну решітку.

Рис. 5.2. Вплив температури на пластичний і крихкий стан
Експлуатаційні властивості
Експлуатаційні властивості характеризують здатність матеріалу працювати в конкретних умовах.
1. Зносостійкість – здатність матеріалу чинити опір поверхневому руйнуванню під дією зовнішнього тертя.
2. Корозійна стійкість – здатність матеріалу чинити опір дії агресивних кислотних і лужних середовищ.
3. Жаростійкість – здатність матеріалу чинити опір окисленню в газовому середовищі за високої температури.
4. Жароміцність – здатність матеріалу зберігати свої властивості за високих температур.
5. Холодостійкість – здатність матеріалу зберігати пластичні властивості за негативних температур.
6. Антифрикційність – здатність матеріалу припрацьовуватися до іншого матеріалу.
Ці властивості визначаються спеціальними випробуваннями залежно від умов роботи виробів.
Вибираючи матеріал для створення конструкції, необхідно повністю враховувати механічні, технологічні й експлуатаційні властивості.
Розділ 6. Залізовуглецеві сплави.
Діаграма стану «залізо – вуглець»
6.1. Залізовуглецеві сплави
Залізовуглецеві сплави – сталі і чавуни – найважливіші металеві сплави сучасної техніки. Виробництво чавуну і сталі за об'ємом перевищує виробництво всіх інших металів, разом узятих, більш ніж вдесятеро.
Діаграма стану «залізо – вуглець» дає основне уявлення про будову залізовуглецевих сплавів – сталей і чавунів. Початок вивченню діаграми «залізо – вуглець» поклав Д. К. Чернов у 1868 році, який вперше вказав на існування в сталі критичних точок і на залежність їх положення від вмісту вуглецю.
Діаграма «залізо – вуглець» повинна розповсюджуватися від заліза до вуглецю. Залізо утворює з вуглецем хімічну сполуку: цементит – Fe3C. Кожну стійку хімічну сполуку можна розглядати як компонент, а діаграму – по частинах. Оскільки на практиці застосовують металеві сплави із вмістом вуглецю до 6,67 %, то розглядаємо частину діаграми стану від заліза до хімічної сполуки цементиту, що містить вуглецю 6,67 %.
Діаграма стану «залізо – цементит» представлена на рис. 6.1.




Рис. 6.1. Діаграма стану «залізо – цементит»
6.2. Компоненти і фази залізовуглецевих сплавів
Компонентами залізовуглецевих сплавів є залізо, вуглець і цементит.
1. Залізо – перехідний метал сріблясто-світлого кольору. Має високу температуру плавлення – 1539 oС.
У твердому стані залізо може знаходитися в двох модифікаціях. Поліморфні перетворення відбуваються за температур 911 oС і 1392 oС. За температури нижче 911 oСіснує Feα з об'ємно-центрованими кубічними ґратами. У інтервалі температур 911–1392 oС стійким є Feγ з гранецентрованими кубічними ґратами. Вище 1392 oС залізо має об'ємно-центровані кубічні ґрати. Високотемпературна модифікація Feα не є новою алотропічною формою. Критичну температуру 911 oС перетворення Feα в Feγ позначають крапкою, а температуру 1392 oС– перетворення А.
За температури нижче 768 oС залізо феромагнітне, а вище – парамагнітне. Точка Кюрі заліза 768 oС позначається G.
Залізо технічної чистоти має невисоку твердість (80 НВ) і міцність (межа міцності – σВ = 250 МПа, межа текучості – σТ = 120 МПа) і високу характеристику пластичності (відносне видовження δ = 50 %, а відносне звуження ψ = 80 %). Властивості можуть змінюватися в деяких межах залежно від величини зерна.
Залізо характеризується високим модулем пружності, наявність якого виявляється і в сплавах на його основі, забезпечуючи високу жорсткість деталей із цих сплавів.
Залізо з багатьма елементами утворює розчини: з металами – розчини заміщення, з вуглецем, азотом і воднем – розчини впровадження.
2. Вуглець належить до неметалів. Здатний до поліморфного перетворення, залежно від умов утворення існує у формі графіту з гексагональною кристалічною решіткою (температура плавлення – 3500 oС, щільність – 2,5 г/см3) або у формі алмазу зі складними кубічними ґратами з координаційним числом рівним чотирьом (температура плавлення – 5000 oС).
У сплавах заліза з вуглецем вуглець знаходиться в стані твердого розчину із залізом і у вигляді хімічної сполуки – цементита (Fe3C), а також у вільному стані у вигляді графіту (у чавунах).
3. Цементит (Fe3C) – хімічна сполука заліза з вуглецем (карбід заліза), містить 6,67 % вуглецю.
Алотропічних перетворень не спостерігається. Кристалічна решітка цементита складається з ряду октаедрів, вісі яких нахилені одна до одної.
Температура плавлення цементиту точно не встановлена (1250–1550 oС). За низьких температур цементит слабо феромагнітний, магнітні властивості втрачає за температури близько 217 oС.
Цементит має високу твердість (більше 800 НВ, легко дряпає скло), але надзвичайно низьку, практично нульову, пластичність. Такі властивості є наслідком складної будови кристалічної решітки.
Цементит здатний утворювати тверді розчини заміщення. Атоми вуглецю можуть заміщатися атомами неметалів: азотом, киснем; атоми заліза – металами: марганцем, хромом, вольфрамом та ін. Такий твердий розчин на базі ґрат цементиту називається легованим цементитом.
Цементит – сполука нестійка і за певних умов розпадається з утворенням вільного вуглецю у вигляді графіту. Цей процес має важливе практичне значення у ході структуроутворення чавунів.
У системі «залізо – цементит» існують наступні фази: рідка фаза, ферит, аустеніт, цементит.
1. Рідка фаза. У рідкому стані залізо добре розчиняє вуглець у будь-яких пропорціях з утворенням однорідної рідкої фази.
2. Ферит (Ф) (C) – твердий розчин впровадження вуглецю в залізо.
Ферит має змінну граничну розчинність вуглецю: мінімальну – 0,006 % (за кімнатної температур), максимальну – 0,02 % (за температури 727 oС). Вуглець розташовується в дефектах ґрат.
За температури вище 1392 oСіснує високотемпературний ферит (Feσ (C)), із граничною розчинністю вуглецю 0,1 % за температури 1499 oC (точка J).
Властивості фериту близькі до властивостей заліза. Він м'який (твердість – 130 НВ, межа міцності σВ = 300 МПа) і пластичний (відносне видовження – σ = 30 %), магнітний до 768 oС.
3. Аустеніт (А) (С) – твердий розчин включення вуглецю в залізо.
Вуглець займає місце в центрі гранецентрованого кубічного осередку.
Аустеніт має змінну граничну розчинність вуглецю: мінімальну – 0,8 % (за температури 727 oС (точка S)), максимальну – 2,14 % (за температури 1147 oС (точка Е)).
Аустеніт має твердість 200–250 НВ, пластичний (відносне видовження σ = 40–50 %), парамагнітний.
У разі розчинення в аустеніті інших елементів, можуть змінюватися властивості і температурні межі існування.
6.3. Структури залізовуглецевих сплавів
Усі сплави системи «залізо – цементит» за структурною ознакою ділять на дві великі групи: сталі і чавуни.
Особливу групу складають сплави із вмістом вуглецю менше 0,02 % (точка Р), їх називають технічне залізо. Мікроструктури сплавів представлені на рис. 6.2. Структура таких сплавів після закінчення кристалізації складається або із зерен фериту (рис. 6.2 а), за вмісту вуглецю менше 0,006 %, або із зерен фериту і кристалів цементиту третинного, розташованих по межах зерен фериту (рис. 6.2 б), якщо вміст вуглецю становить від 0,006 до 0,02 %.

а) б)
Рис. 6.2. Мікроструктури технічного заліза:
а – вміст вуглецю менше 0,006 %;
б – вміст вуглецю становить 0,006–0,02 %
Вуглецевими сталями називають сплави заліза з вуглецем (містять 0,02–2,14 % вуглецю), що закінчують кристалізацію утворенням аустеніту. Вони мають високу пластичністю, особливо в аустенітному стані.
Структура сталей формується в результаті перекристалізації аустеніту. Мікроструктури сталей представлені на рис. 6.3.
 |
а) б) в) г)
Рис. 6.3. Мікроструктури сталей: а – доевтектоїдна сталь;
б – евтектоїдна сталь (пластинчастий перліт); в – евтектоїдна сталь (зернистий перліт); г – заевтектоїдна сталь
За вмістом вуглецю і структурою сталі поділяються на доевтектоїдні – структура ферит + перліт (рис. 6.3 а); евтектоїдні – структура перліт (П), перліт може бути пластинчастий або зернистий (рис. 6.3 б і 6.3 в); заевтектоїдні – структура перліт + цементит вторинний (П + ЦII), цементитна ґратка розташовується навколо зерен перліту.
За мікроструктурою сплавів можна приблизно визначити кількість вуглецю у складі сплаву, враховуючи наступне: кількість вуглецю в перліті складає 0,8 %, у цементиті – 6,67 %. Зважаючи на малу розчинність вуглецю у фериті, приймається, що в ньому вуглецю немає.
Сплави заліза з вуглецем, що містять вуглецю більше 2,14 % (до 6,67 %) й закінчують кристалізацію утворенням евтектики (ледебуриту), називають чавунами.
Наявність легкоплавкого ледебуриту в структурі чавунів підвищує їх ливарні властивості.
Чавуни, що кристалізуються відповідно до діаграми стану «залізо – цементит», відрізняються високою крихкістю. Колір їх зламу – сріблясто-білий. Такі чавуни називаються білими чавунами.
Мікроструктури білих чавунів представлені на рис. 6.4.
а) б) в)
 |  |  | |||
Рис. 6.4. Мікроструктури білих чавунів: а – доевтектичний білий чавун; б – евтектичний білий чавун; в – заевтектичний білий чавун
За кількістю вуглецю і структурою білі чавуни поділяються на: доевтектичні – структура перліт + ледебурит + цементит вторинний; евтектичні – структура ледебурит (рис. 6.4 б); заевтектичні – структура ледебурит + цементит первинний (рис. 6.4 в).
У структурі доевтектичних білих чавунів присутній цементит вторинний, який утворюється в результаті зміни складу аустеніту під час охолодженні (по лінії ES). У структурі цементит вторинний зливається з цементитом, що входить до складу ледебуриту.
Фазовий склад сталей і чавунів за нормальних температур один і той же, вони складаються з фериту і цементиту. Проте властивості сталей і білих чавунів значно відрізняються. Таким чином, основним чинником, що визначає властивості сплавів системи «залізо – цементит», є їх структура.
Розділ 7. СталІ.
Класифікація і маркування сталей
7.1. Вплив вуглецю і домішок на властивості сталей
Сталі є найбільш поширеними матеріалами, оскільки володіють гарними механічними і технологічними властивостями. Вироби отримують у результаті обробки тиском і різанням.
Сталі поділяють на вуглецеві і леговані.
Вуглецеві сталі є основними. Їх властивості визначаються кількістю вуглецю і вмістом домішок, які взаємодіють із залізом і вуглецем.
Вплив вуглецю
Вплив вуглецю на властивості сталей показаний на рис. 7.1.
|

|

|

|

|
|
| |
| |
| |
| |
|
|
|
|
| |
| |
| |
| |
| |
|
| |
| |
| |
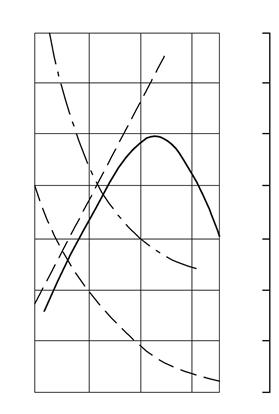
Рис. 7.1. Вплив вуглецю на властивості сталей
Зі зростанням умісту вуглецю в структурі сталі збільшується кількість цементиту за одночасного зниження частки фериту. Зміна співвідношення між складовими призводить до зменшення пластичності, а також до підвищення міцності і твердості. Міцність підвищується до вмісту вуглецю близько 1 %, а потім вона зменшується, оскільки утворюється груба ґратка цементиту вторинного.
Вуглець впливає також і на в'язкі властивості. Збільшення вмісту вуглецю підвищує поріг холодокрихкості і знижує ударну в'язкість, підвищуються електроопір, знижуються магнітна проникність і щільність магнітної індукції.
Вуглець впливає і на технологічні властивості. Підвищення вмісту вуглецю погіршує ливарні властивості сталі (використовуються сталі із вмістом вуглецю до 0,4 %), оброблюваність тиском і різанням, зварюваність. Слід враховувати, що сталь із низьким умістом вуглецю також погано обробляється різанням.
Вплив домішок
У сталях завжди присутні домішки, що поділяються на чотири групи.
1. Постійні домішки: кремній, марганець, сірка, фосфор.
Марганець і кремній вводяться в процесі виплавки сталі для розкислювання, вони є технологічними домішками.
Вміст марганцю не перевищує 0,5–0,8 %. Марганець підвищує міцність, не знижуючи пластичності, і різко знижує червоноламкість сталі, викликану впливом сірки. Він сприяє зменшенню вмісту сульфіду заліза FеS, оскільки утворює з сіркою з'єднання сульфід марганцю MnS. Частинки сульфіду марганцю розташовуються у вигляді окремих включень, які деформуються і виявляються витягнутими вздовж напряму стискання.
Вміст кремнію не перевищує 0,35–0,4 %. Кремній, дегазуючи метал, підвищує щільність злитку.
|
© 2013 wikipage.com.ua - Дякуємо за посилання на wikipage.com.ua | Контакти |