
Опис пристрою та методу вимірювання
|
|
Пристрій складається з скляного балону (1) об’ємом 12 л, гофрованої трубки (2), штока (3), рукоятки пружинного клапану (4), пружинного клапану (5), стопору (6), рукоятки штоку (7), водяного манометра (8) рис. 18.1.
Балон може сполучатись з атмосферою за допомогою пружинного клапану. Опускаючи чи піднімаючи рукоятку штока, можна збільшити або зменшити об’єм газу в балоні за рахунок розтягування або стискування гофрованої трубки. Стопор використовується для фіксування штока в верхньому положенні; водяним манометром вимірюється різниця тиску повітря в балоні та поза ним.
Під час виконання лабораторної роботи в балоні проходять чотири термодинамічних процеси. Розглянемо їх у тій послідовності, в якій вони проходять в лабораторній установці. Накачаємо в балон об'ємом V1 небагато повітря. Зазначимо, що це повітря не впливає на параметри того повітря, з яким в балоні здійснюються термодинамічні процеси; накачане повітря в термодинамічних рівняннях не бере участі. Це призведе до стиснення повітря балону до об'єму V2. На графіку (рис.18.2) це ділянка 1÷2. Цей перший процес проходить нерівномірно і неоднозначно. Тому графічно його показати неможливо і він зображений умовно штрих-пунктирною лінією.

Рисунок 18.1

Рисунок 18.2
Відразу зазначимо, що реально в "чистому" вигляді провести жоден процес неможливо. Тому в подальшому визначати процеси ми будемо з деяким наближенням.
Оскільки при стисканні повітря зовнішніми силами виконувалася деяка робота, то повітря в балоні нагрілося і після припинення накачування воно почне охолоджуватися. Невеликими тепловими змінами об'єму скляного балона можна знехтувати і тоді другим процесом у балоні буде ізохорне охолодження газу (на графіку ділянка 2 ÷ 3). Як тільки температура повітря у балоні стане дорівнювати температурі навколишнього середовища (кімнатній), охолодження припиниться.
Тиск повітря в балоні можна виразити так:
 , (18.1)
, (18.1)
де P1 - атмосферний тиск повітря, DP1=rgh1 - тиск, який показує рідинний манометр; h1 - різниця рівнів рідини в колінах манометра.
Третій процес, що виконується в роботі, є адіабатне розширення повітря до об'єму V3. Це основний процес в роботі, тому дуже важливо провести його правильно.
Адіабатний процес - це процес, що проходить без теплообміну з навколишнім середовищем. Він буде ідеальним, якщо стінки балона з газом будуть абсолютно нетеплопровідними. Якщо стінки пропускають тепло, то за час розширення відбудеться частковий теплообмін. Чим коротший проміжок часу розширення, тим меншим буде теплообмін. Очевидно, можна так швидко провести процес розширення, що теплообміном можна знехтувати і тоді цей процес можна вважати адіабатним. Звідси: якість проведення третього процесу залежить від швидкості - чим швидше він буде проведений, тим процес буде якіснішим, тобто більш наближеним до адіабатного.
Отже, швидко проведемо розширення повітря в балоні, максимально відтягнувши рукоятку пружинного клапану 4. Оптимальний час розширення 1÷2 секунди. Па графіку - це ділянка 3÷4. У кінці процесу тиск падає до атмосферного P1, об'єм стане дорівнювати V3, а температура T3 стане нижчою за кімнатну.
Рівняння адіабатного процесу , що відбувся у нашому випадку, може бути записаним у такому вигляді:
 (18.2)
(18.2)
Після завершення третього процесу розпочнеться четвертий - ізохорне нагрівання повітря (ділянка 4÷5 на графіку). Закінчується він при досягненні повітрям температури T1. При цьому тиск повітря в балоні буде дорівнювати
 , (18.3)
, (18.3)
де DP2=rgh2 - тиск, який показує манометр. Рівняння останнього ізохорного процесу має вигляд
 . (18.4)
. (18.4)
Об'єднаємо рівняння (18.2) й (18.4). виключивши з них температури Т1 і Т3
 .
.
Підставивши сюди P3 і P4 з рівнянь (18.1) і (18.3), одержимо
 . (18.5)
. (18.5)
Застосувавши до виразу (18.5) формулу бінома Ньютона і враховуючи, що rgh1<< P1 і rgh2<< P2 одержимо
 Þ
Þ 
Звідки
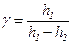 . (18.6)
. (18.6)
Формула (18.6) є розрахунковою.
Порядок виконання роботи
1. Опустите до упору рукоятку штока (7).
2. Відтягнути рукоятку пружинного клапану (4), коли рівні рідини в манометрі зрівняються, відпустити рукоятку.
3. Підняти рукоятку штока (7) і зафіксувати її стопором (6).
4. Через 2 хвилини записати значення різниці рівнів рідини в манометрі – h1.
5. Відтягнути на 0,5 с рукоятку пружинного клапану (4).
6. Через 2 хвилини записати значення рівнів рідини в манометрі – h2.
7. Повторити дослід по пунктам 1 ÷ 6 ще два рази, значення рівнів записати в таблицю 18.1.
8. Визначити gдля значеньh1 та h2 за формулою (18.6).
Таблиця 18.1
| № | h1 | h2 | g | 
|
9. Визначити відносну похибку gза формулою:
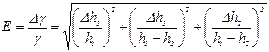
При цьому величинуh1 та h2 взяти для будь-якого з дослідів, а півширину довірчого інтервалу Dh1 = Dh2 знайти за формулою для одноразового вимірювання. Для шкали манометра d= 1 мм, u = 0,5 мм.
10. Знайти півширину довірчого інтервалу за формулою
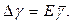
11. Обчислити величину g для повітря за формулою 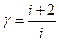 та порівняти її з одержаною в досліді величиною
та порівняти її з одержаною в досліді величиною  . i для двохатомного газу = 5, для 3-х = 6.
. i для двохатомного газу = 5, для 3-х = 6.
12. Обчисліть молярні і питомі теплоємності повітря при сталому об'ємі і сталому тиску.



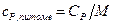 ,
,
де  – показник адіабати, значення якого одержане в лабораторній роботі; R=8,31 Дж/(моль-К); M=29 10-3 кг/моль.
– показник адіабати, значення якого одержане в лабораторній роботі; R=8,31 Дж/(моль-К); M=29 10-3 кг/моль.
Контрольні запитання
1. Назвіть ізопроцеси в ідеальних газах. Дайте пояснення, чим вони відрізняються?
2. Сформулюйте та запишіть перший закон термодинаміки.
3. Запишіть перший закон термодинаміки для кожного ізопроцесу.
4. Дати визначення числа ступенів свободи.
5. За якою формулою визначається середнє значення кінетичної енергії поступального руху молекули?
6. Яка середня енергія припадає на один ступінь свободи?
7. За якою формулою визначається внутрішня енергія ідеального газу?
8. Дайте визначення теплоємності, питомої та молярної теплоємності.
9. Чому теплоємність при сталому тиску більша теплоємності при сталому об’ємі?
10. Як пов’язані теплоємність при сталому тиску та теплоємність при сталому об’ємі з числом ступенів свободи?
11. Запишіть формулу для обчислення величин співвідношення Cp/Cv через число ступенів свободи.
Інструкція складена старшим викладачем кафедри
фізики Денисовой О.І.
Відредагував доцент кафедри фізики Золотаревський І. В.
Затверджена на засіданні кафедри фізики,
протокол № 3 від 01.12.2008 р.
|
© 2013 wikipage.com.ua - Дякуємо за посилання на wikipage.com.ua | Контакти |