
Доповнення до лекції «Електрохімічні процеси»
|
|
Доповнення до лекції «Електрохімічні процеси»
Акумулятори
Акумулятори – це вторинні джерела електричного струму (це пристрої, в яких електрична енергія перетворюється в хімічну а хімічна – знову в електричну). В акумуляторах під дією зовнішнього джерела струму накопичується (акумулюється) хімічна енергія, яка потім переходить в електричну. Процеси накопичення хімічної енергії отримали назву зарядки акумулятора, а процеси перетворення хімічної енергії в електричну – розрядки акумулятора. При зарядці акумулятор працює як електролізер, при розрядці – як гальванічний елемент.
Найбільш розповсюджені:
1) свинцевий (кислотний) акумулятор– це зворотній гальванічний елемент, в якому негативним електродом є система свинцевих перфорованих пластин, заповнених губчастим свинцем, а позитивним електродом є плюмбум диоксид (PbO2) впресований в свинцеві ґратки. Як електроліт використовують 30% розчин H2SO4. В розрядженому стані обидві пластини складаються з плюмбум сульфату. При зарядці пластини сполучають з джерелом постійного струму і через акумулятор пропускають електричний струм. При цьому на негативному електроді (аноді) протікають реакції при яких ступінь окиснення Плюмбуму міняється з +2 до 0, а на позитивному електроді (катоді) – від +2 до +4.
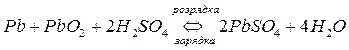
Схема:
 | |||||
 | |||||
 | |||||

| 
| 
|
ЕРС залежить від концентрації кислоти і дорівнює  . При зниженні напруги до
. При зниженні напруги до 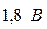 акумулятор вважається розрядженим. ККД ~ 80%. В автомобільних акумуляторах шість блоків таких пластин і DE0= 12 В. Недоліки – невисока питома енергія 20-30 Вт×год/кг; саморозряд при збереженні; малий термін служби (2-5 років).
акумулятор вважається розрядженим. ККД ~ 80%. В автомобільних акумуляторах шість блоків таких пластин і DE0= 12 В. Недоліки – невисока питома енергія 20-30 Вт×год/кг; саморозряд при збереженні; малий термін служби (2-5 років).
2) залізо-нікелевий акумулятор (лужний) – електроліт 20-30% розчин 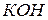 . Активна маса негативного електроду – губчасте залізо, позитивного електроду
. Активна маса негативного електроду – губчасте залізо, позитивного електроду 
Схема:

Працює при напрузі  , при
, при  – вважається розрядженим.
– вважається розрядженим.
Має менший ККД ~ 50% порівняно з кислотним акумулятором, але в ряді випадків має переваги: менша маса і довший термін дії, а також простіше обслуговування.
Хемотрони
Хемотронами називають прилади і окремі елементи пристроїв, принцип дії яких базується на законах електрохімії.
Елементи або системи такого роду використовують як діоди, датчики, інтегратори, запам’ятовуючі пристрої, і відповідно виконують функції випрямлення, посилення і генерування електричних сигналів, вимірювання неелектричних величин та ін.. В них відбувається перетворення електричної енергії в хімічну, а також хімічної – в електричну. На відміну від електронних пристроїв (лампових, напівпровідникових), в яких перенос електрики відбувається за рахунок електронів, в хемотронах (електрохімічні перетворювачі) заряди переносяться йонами.
Згідно з законом Фарадея кількість речовини, яка зазнала зміни на електродах, пропорційна кількості електрики, яка пройшла через електроліт. Тому вимірюючи тим чи іншим методом кількісну зміну речовини, можна визначити кількість електрики.
Для цього електрохімічна реакція повинна бути:
1) зворотною, тобто реакція на катоді повинна бути зворотною реакцією на аноді.
К: 
А: 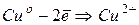
2) реакція повинна бути тільки однією
3) електроліти і електроди повинні бути стійкими у часі
4) реакції на електродах повинні відбуватися з достатньою швидкістю
Наприклад:
1) Хемотронний інтегратор (лічильник):
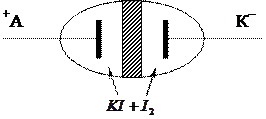 |
Використовують для визначення кількості електрики. Це закрита комірка з платиновими електродами, між ними – водний розчин  . Катодний простір відокремлено від анодного протистою діафрагмою, яка не дозволяє розчинам змішуватись. При пропусканні електричного струму через комірку на електродах відбувається реакція:
. Катодний простір відокремлено від анодного протистою діафрагмою, яка не дозволяє розчинам змішуватись. При пропусканні електричного струму через комірку на електродах відбувається реакція:
К: 
А:  ,
, 
В результаті реакції збільшується концентрація йоду в анодному просторі і йонів 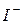 – в катодному. За зміною концентрації можна виміряти кількість електрики, що пройшла:
– в катодному. За зміною концентрації можна виміряти кількість електрики, що пройшла:
а) для цього використовують фотоколориметричний метод – вимірювання інтенсивності забарвлення за допомогою фотоколориметра (І- – безбарвна речовина, І2 – забарвлена);
б) можна використовувати метод вимірювання ЕРС – вимір різниці потенціалів в катодному і анодному просторах і за рівнянням Нернста розраховують концентрації.
Такий прилад може тривалий час “пам’ятати” яка кількість електрики пройшла через нього. При необхідності систему можна регенерувати, пропустивши струм в зворотному напрямку.
2) Як інтегратор може слугувати також електролізна комірка, в якій на катоді відбувається відновлення міді, а на аноді – окислення. Їх називають кулонометрами. Йонним провідником слугує розчин  .
.
К: 
А: 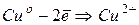
Кількість електрики, що пройшла можна визначити за зміною маси мідного катоду.
3) Інтегратори можна використовувати як лічильники часу:
 |
К: 
А: 
Це система з двох ртутних електродів і розчину електроліту між ними. При пропусканні струму анод розчиняється, а на катоді виділяється металева ртуть. Внаслідок цього відбувається переміщення границі електродів і бульбашки електроліту між ними. Остання і показує час, який пройшов після включення інтегратора, тобто вимірює машинний час. Розраховано на тривалий період експлуатації.
4) Електрохімічний діод (випрямляч):
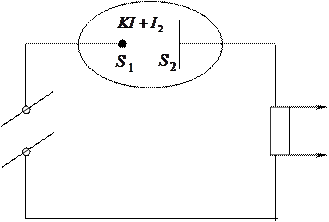 |
 ;
;  разів.
разів.
Використовують в низькочастотних ланцюгах зі слабими сигналами при напрузі нижче 0,3 В. Діод являє собою закриту комірку, яка заповнена розчином  , причому концентрація калій йодиду значно більша, ніж концентрація йоду (
, причому концентрація калій йодиду значно більша, ніж концентрація йоду (  і більше). В комірці розташовані два платинові електроди: один точковий з площею поверхні S1, а другий – з площею поверхні S2, причому площа поверхні
і більше). В комірці розташовані два платинові електроди: один точковий з площею поверхні S1, а другий – з площею поверхні S2, причому площа поверхні  разів. Такий діод вводиться в ланцюг змінного струму низької частоти під напругою 0,3 В і нижче. Сила струму в діоді контролюється одним із електродів. Сила струму на електроді залежить від площі електродів, концентрації реагентів:
разів. Такий діод вводиться в ланцюг змінного струму низької частоти під напругою 0,3 В і нижче. Сила струму в діоді контролюється одним із електродів. Сила струму на електроді залежить від площі електродів, концентрації реагентів:
 ,
,
де  – максимальна сила струму;
– максимальна сила струму;  – максимальна (гранична) густина струму;
– максимальна (гранична) густина струму;  – поверхня електродів;
– поверхня електродів;  – число перехідних електронів;
– число перехідних електронів;  – коефіцієнт дифузії реагенту;
– коефіцієнт дифузії реагенту;  – концентрація реагенту в об’ємі розчину;
– концентрація реагенту в об’ємі розчину;  – товща дифузного шару.
– товща дифузного шару.
За даним рівнянням можна легко розрахувати, що сила струму на точковому електроді завжди менша сили струму на великому електроді, тому що  . Тому сила струму, яка проходить через комірку, визначається силою струму точкового електроду. Коли точковий електрод є анодом:
. Тому сила струму, яка проходить через комірку, визначається силою струму точкового електроду. Коли точковий електрод є анодом:
 ,
,
тоді 
Якщо змінити полюси і точковий електрод буде виступати катодом:


Коефіцієнти дифузії Д приблизно рівні, а концентрації речовин значно відрізняються, тому відношення прямого струму до зворотного буде визначатися концентрацією речовин. Так як концентрація 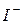 значно більше концентрації
значно більше концентрації  , тоді сила прямого струму буде значно більша, ніж сила зворотного. Таким чином, струм проходить в основному прямому напрямку і комірка випрямляє струм.
, тоді сила прямого струму буде значно більша, ніж сила зворотного. Таким чином, струм проходить в основному прямому напрямку і комірка випрямляє струм.
Корозія металів
Корозія – це самодовільний процес руйнування металів під дією навколишнього середовища. В результаті корозії утворюється оксиди, гідроксиди, солі, тобто вільний метал переходить в зв’язаний стан і це супроводжується зменшенням вільної енергії системи, тобто  .
.
За видом корозійних руйнувань розрізняють:
1)  Суцільну корозію:
Суцільну корозію:
а) рівномірну;
б) нерівномірну;
Локальну корозію
а) точкова
 б) пітінгами (мікротріщини), дуже
б) пітінгами (мікротріщини), дуже
небезпечна; якщо  ,
,

 то в піттінгах
то в піттінгах 
|
|
ґрунтової корозії
г) міжкрісталічна – на границі
зерен металу
За механізмом дії розрізняють:
1) хімічну корозію
2) електрохімічну корозію
Хімічна корозія виникає в результаті хімічної дії корозійного середовища без утворення електричного струму. Наприклад, газова корозія – взаємодія металів з агресивними газами (під температурою: сопла літаків, лопасті газових турбін, різаки і т.д.)
Відбувається в середовищі неелектроліту.
Електрохімічна корозія – це руйнування металу в середовищі електроліту в результаті електрохімічних процесів. Анодний процес – завжди окислення металу, тобто його руйнування. Катодний процес – це зв’язування електронів, які виділилися на аноді тим чи іншим шляхом (киснева або воднева деполяризація).
Основні закони термохімії
Хімічні реакції супроводжуються виділенням (  ) та поглинанням (
) та поглинанням (  ) теплоти. Перші називаються екзотермічними, другі – ендотермічними. Наприклад:
) теплоти. Перші називаються екзотермічними, другі – ендотермічними. Наприклад:
 – це екзотермічна реакція.
– це екзотермічна реакція.
Область хімії, яка вивчає термохімічні процеси. називається термохімією. В основі її лежать закони:
1. Закон Лавуаз’є Лапласа – тепловий ефект прямої реакції дорівнює тепловому ефекту зворотної реакції з протилежним знаком:
 (3.1)
(3.1)
2. Закон Гесса (1840 р.) – тепловий ефект реакції залежить тільки від початкового і кінцевого стану реагуючих речовин і не залежить від проміжних стадій процесу.
Висновок:тепловий ефект хімічної реакції дорівнює сумі теплових ефектів продуктів реакцій за виключенням суми теплових ефектів початкових речовин з урахуванням коефіцієнтів реакції.
 (3.2)
(3.2)
Наприклад: 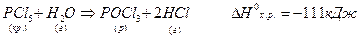
Ця реакція означає, що при взаємодії кристалів фосфору пентахлориду з парами води утворився рідкий фосфору оксохлорид і водню хлорид і реакція супроводжується виділенням 111 кДж тепла (екзотермічна).

де  – теплота утворення 1 моля складної речовини з простих речовин при стандартних умовах (температура 25 ºС = 298 К, тиск 101,3 кПа). Це довідковий показник (відомо більше 4000).
– теплота утворення 1 моля складної речовини з простих речовин при стандартних умовах (температура 25 ºС = 298 К, тиск 101,3 кПа). Це довідковий показник (відомо більше 4000).
 простих речовин (Fe, O2, H2, Al та інш.) завжди дорівнює нулю.
простих речовин (Fe, O2, H2, Al та інш.) завжди дорівнює нулю.
І закон термодинаміки
В основі хімічної термодинаміки лежить закон збереження енергії (І закон термодинаміки або І початок термодинаміки) – Енергія замкненої системи величина стала (вічний двигун першого роду не можливий – тобто не можливо створити машину, яка б виконувала механічну роботу без затрати енергії):

Тобто, підведена до системи теплота Q витрачається на зміну внутрішньої енергії системи  та виконання роботи А.
та виконання роботи А.
Теплоємність
Теплоємність – кількість теплоти, необхідна для нагрівання маси речовини на один градус.
Питома теплоємність – це кількість теплоти необхідна для нагрівання одного граму речовини на один градус; мольна теплоємність – це кількість теплоти необхідна для нагрівання одного моля речовини на один градус.
Доповнення до лекції «Електрохімічні процеси»
Акумулятори
Акумулятори – це вторинні джерела електричного струму (це пристрої, в яких електрична енергія перетворюється в хімічну а хімічна – знову в електричну). В акумуляторах під дією зовнішнього джерела струму накопичується (акумулюється) хімічна енергія, яка потім переходить в електричну. Процеси накопичення хімічної енергії отримали назву зарядки акумулятора, а процеси перетворення хімічної енергії в електричну – розрядки акумулятора. При зарядці акумулятор працює як електролізер, при розрядці – як гальванічний елемент.
Найбільш розповсюджені:
1) свинцевий (кислотний) акумулятор– це зворотній гальванічний елемент, в якому негативним електродом є система свинцевих перфорованих пластин, заповнених губчастим свинцем, а позитивним електродом є плюмбум диоксид (PbO2) впресований в свинцеві ґратки. Як електроліт використовують 30% розчин H2SO4. В розрядженому стані обидві пластини складаються з плюмбум сульфату. При зарядці пластини сполучають з джерелом постійного струму і через акумулятор пропускають електричний струм. При цьому на негативному електроді (аноді) протікають реакції при яких ступінь окиснення Плюмбуму міняється з +2 до 0, а на позитивному електроді (катоді) – від +2 до +4.
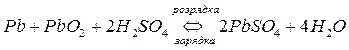
Схема:
 | |||||
 | |||||
 | |||||

| 
| 
|
ЕРС залежить від концентрації кислоти і дорівнює  . При зниженні напруги до
. При зниженні напруги до 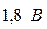 акумулятор вважається розрядженим. ККД ~ 80%. В автомобільних акумуляторах шість блоків таких пластин і DE0= 12 В. Недоліки – невисока питома енергія 20-30 Вт×год/кг; саморозряд при збереженні; малий термін служби (2-5 років).
акумулятор вважається розрядженим. ККД ~ 80%. В автомобільних акумуляторах шість блоків таких пластин і DE0= 12 В. Недоліки – невисока питома енергія 20-30 Вт×год/кг; саморозряд при збереженні; малий термін служби (2-5 років).
2) залізо-нікелевий акумулятор (лужний) – електроліт 20-30% розчин 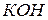 . Активна маса негативного електроду – губчасте залізо, позитивного електроду
. Активна маса негативного електроду – губчасте залізо, позитивного електроду 
Схема:

Працює при напрузі  , при
, при  – вважається розрядженим.
– вважається розрядженим.
Має менший ККД ~ 50% порівняно з кислотним акумулятором, але в ряді випадків має переваги: менша маса і довший термін дії, а також простіше обслуговування.
Хемотрони
Хемотронами називають прилади і окремі елементи пристроїв, принцип дії яких базується на законах електрохімії.
Елементи або системи такого роду використовують як діоди, датчики, інтегратори, запам’ятовуючі пристрої, і відповідно виконують функції випрямлення, посилення і генерування електричних сигналів, вимірювання неелектричних величин та ін.. В них відбувається перетворення електричної енергії в хімічну, а також хімічної – в електричну. На відміну від електронних пристроїв (лампових, напівпровідникових), в яких перенос електрики відбувається за рахунок електронів, в хемотронах (електрохімічні перетворювачі) заряди переносяться йонами.
Згідно з законом Фарадея кількість речовини, яка зазнала зміни на електродах, пропорційна кількості електрики, яка пройшла через електроліт. Тому вимірюючи тим чи іншим методом кількісну зміну речовини, можна визначити кількість електрики.
Для цього електрохімічна реакція повинна бути:
1) зворотною, тобто реакція на катоді повинна бути зворотною реакцією на аноді.
К: 
А: 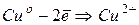
2) реакція повинна бути тільки однією
3) електроліти і електроди повинні бути стійкими у часі
4) реакції на електродах повинні відбуватися з достатньою швидкістю
Наприклад:
1) Хемотронний інтегратор (лічильник):
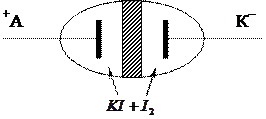 |
Використовують для визначення кількості електрики. Це закрита комірка з платиновими електродами, між ними – водний розчин  . Катодний простір відокремлено від анодного протистою діафрагмою, яка не дозволяє розчинам змішуватись. При пропусканні електричного струму через комірку на електродах відбувається реакція:
. Катодний простір відокремлено від анодного протистою діафрагмою, яка не дозволяє розчинам змішуватись. При пропусканні електричного струму через комірку на електродах відбувається реакція:
К: 
А:  ,
, 
В результаті реакції збільшується концентрація йоду в анодному просторі і йонів 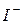 – в катодному. За зміною концентрації можна виміряти кількість електрики, що пройшла:
– в катодному. За зміною концентрації можна виміряти кількість електрики, що пройшла:
а) для цього використовують фотоколориметричний метод – вимірювання інтенсивності забарвлення за допомогою фотоколориметра (І- – безбарвна речовина, І2 – забарвлена);
б) можна використовувати метод вимірювання ЕРС – вимір різниці потенціалів в катодному і анодному просторах і за рівнянням Нернста розраховують концентрації.
Такий прилад може тривалий час “пам’ятати” яка кількість електрики пройшла через нього. При необхідності систему можна регенерувати, пропустивши струм в зворотному напрямку.
2) Як інтегратор може слугувати також електролізна комірка, в якій на катоді відбувається відновлення міді, а на аноді – окислення. Їх називають кулонометрами. Йонним провідником слугує розчин  .
.
К: 
А: 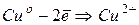
Кількість електрики, що пройшла можна визначити за зміною маси мідного катоду.
3) Інтегратори можна використовувати як лічильники часу:
 |
К: 
А: 
Це система з двох ртутних електродів і розчину електроліту між ними. При пропусканні струму анод розчиняється, а на катоді виділяється металева ртуть. Внаслідок цього відбувається переміщення границі електродів і бульбашки електроліту між ними. Остання і показує час, який пройшов після включення інтегратора, тобто вимірює машинний час. Розраховано на тривалий період експлуатації.
4) Електрохімічний діод (випрямляч):
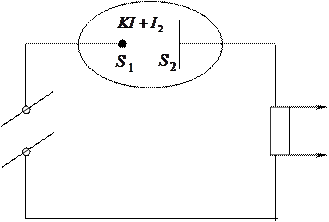 |
 ;
;  разів.
разів.
Використовують в низькочастотних ланцюгах зі слабими сигналами при напрузі нижче 0,3 В. Діод являє собою закриту комірку, яка заповнена розчином  , причому концентрація калій йодиду значно більша, ніж концентрація йоду (
, причому концентрація калій йодиду значно більша, ніж концентрація йоду (  і більше). В комірці розташовані два платинові електроди: один точковий з площею поверхні S1, а другий – з площею поверхні S2, причому площа поверхні
і більше). В комірці розташовані два платинові електроди: один точковий з площею поверхні S1, а другий – з площею поверхні S2, причому площа поверхні  разів. Такий діод вводиться в ланцюг змінного струму низької частоти під напругою 0,3 В і нижче. Сила струму в діоді контролюється одним із електродів. Сила струму на електроді залежить від площі електродів, концентрації реагентів:
разів. Такий діод вводиться в ланцюг змінного струму низької частоти під напругою 0,3 В і нижче. Сила струму в діоді контролюється одним із електродів. Сила струму на електроді залежить від площі електродів, концентрації реагентів:
 ,
,
де  – максимальна сила струму;
– максимальна сила струму;  – максимальна (гранична) густина струму;
– максимальна (гранична) густина струму;  – поверхня електродів;
– поверхня електродів;  – число перехідних електронів;
– число перехідних електронів;  – коефіцієнт дифузії реагенту;
– коефіцієнт дифузії реагенту;  – концентрація реагенту в об’ємі розчину;
– концентрація реагенту в об’ємі розчину;  – товща дифузного шару.
– товща дифузного шару.
За даним рівнянням можна легко розрахувати, що сила струму на точковому електроді завжди менша сили струму на великому електроді, тому що  . Тому сила струму, яка проходить через комірку, визначається силою струму точкового електроду. Коли точковий електрод є анодом:
. Тому сила струму, яка проходить через комірку, визначається силою струму точкового електроду. Коли точковий електрод є анодом:
 ,
,
тоді 
Якщо змінити полюси і точковий електрод буде виступати катодом:


Коефіцієнти дифузії Д приблизно рівні, а концентрації речовин значно відрізняються, тому відношення прямого струму до зворотного буде визначатися концентрацією речовин. Так як концентрація 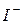 значно більше концентрації
значно більше концентрації  , тоді сила прямого струму буде значно більша, ніж сила зворотного. Таким чином, струм проходить в основному прямому напрямку і комірка випрямляє струм.
, тоді сила прямого струму буде значно більша, ніж сила зворотного. Таким чином, струм проходить в основному прямому напрямку і комірка випрямляє струм.
Корозія металів
Корозія – це самодовільний процес руйнування металів під дією навколишнього середовища. В результаті корозії утворюється оксиди, гідроксиди, солі, тобто вільний метал переходить в зв’язаний стан і це супроводжується зменшенням вільної енергії системи, тобто  .
.
За видом корозійних руйнувань розрізняють:
1)  Суцільну корозію:
Суцільну корозію:
а) рівномірну;
б) нерівномірну;
Локальну корозію
а) точкова
 б) пітінгами (мікротріщини), дуже
б) пітінгами (мікротріщини), дуже
небезпечна; якщо  ,
,

 то в піттінгах
то в піттінгах 
|
|
ґрунтової корозії
г) міжкрісталічна – на границі
зерен металу
За механізмом дії розрізняють:
1) хімічну корозію
2) електрохімічну корозію
Хімічна корозія виникає в результаті хімічної дії корозійного середовища без утворення електричного струму. Наприклад, газова корозія – взаємодія металів з агресивними газами (під температурою: сопла літаків, лопасті газових турбін, різаки і т.д.)
Відбувається в середовищі неелектроліту.
Електрохімічна корозія – це руйнування металу в середовищі електроліту в результаті електрохімічних процесів. Анодний процес – завжди окислення металу, тобто його руйнування. Катодний процес – це зв’язування електронів, які виділилися на аноді тим чи іншим шляхом (киснева або воднева деполяризація).
|
© 2013 wikipage.com.ua - Дякуємо за посилання на wikipage.com.ua | Контакти |