
СОВРЕМЕННАЯ ТЕОРИЯ БИООКИСЛЕНИЯ
|
|
Согласно СОВРЕМЕННОЙ ТЕОРИИ БИООКИСЛЕНИЯ в нашем организме окисление может происходить двумя способами:
1. Путем отнятия водорода от окисляемого субстрата: сюда относятся МИТОХОНДРИАЛЬНОЕ ОКИСЛЕНИЕ и ВНЕМИТОХОНДРИАЛЬНОЕ ОКИСЛЕНИЕ ОКСИДАЗНОГО ТИПА.
2. Путем присоединения кислорода к окисляемому субстрату - так происходит внемитохондриальное ОКИСЛЕНИЕ ОКСИГЕНАЗНОГО ТИПА (старое название - МИКРОСОМАЛЬНОЕ окисление).
МИТОХОНДРИАЛЬНОЕ ОКИСЛЕНИЕ (МтО).
Система митохондриального окисления - мультиферментная система, постепенно транспортирующая протоны и электроны на кислород с образованием молекулы воды.
Все ферменты митохондриального окисления встроены во внутреннюю мембрану митохондрий. Только первый переносчик протонов и электронов - никотинамидная дегидрогеназа расположена в матриксе митохондрии. Этот фермент отнимает водород от субстрата и передает его следующему переносчику. Полный комплекс таких ферментов образует "дыхательный ансамбль" («дыхательную цепь»), в пределах которого атомы водорода отнимаются от субстрата, затем передаются последовательно от одного переносчика к другому, и, наконец, передаются на кислород воздуха с образованием воды.
Существует строгая последовательность работы каждого звена в цепочке переносчиков. Эта последовательность определяется величиной РЕДОКС-ПОТЕНЦИАЛА (ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОГО ПОТЕНЦИАЛА, сокращенно - ОВП) каждого звена. ОВП - это химическая характеристика способности вещества принимать и удерживать электроны. Выражается в вольтах (V). Вещества с положительным ОВП окисляют водород (отнимают от него электроны), вещества с отрицательным ОВП окисляются самим водородом. Самый низкий ОВП имеет начальное звено цепи, самый высокий - у кислорода, расположенного в конце цепочки переносчиков. Таким образом, передача водорода идет от более низкого к более высокому ОВП. Перенос водорода и электронов возможен только в одном направлении - в порядке возрастания их ОВП: от -0.32V у никотинамидных дегидрогеназ (первого компонента главной цепи МтО) до 0.82V у О2, обладающего самым высоким редокс-потенциалом.
На одной из стадий происходит разделение атомов водорода на Н+ и электроны. Протоны остаются временно в окружающей среде, а электроны идут дальше по цепи и в ее конце используются для активации О2. Кислород является конечным акцептором электронов.
O2 + 4e -----> 2O-2 (полное восстановление кислорода)
Все реакции, происходящие в дыхательной цепи, сопряжены. Переносчики водорода и электронов расположены в строгом порядке, в соответствии с величиной их редокс-потенциала.
В настоящее время различают три варианта дыхательных цепей: 1)
ГЛАВНАЯ (ПОЛНАЯ) ЦЕПЬ
2) УКОРОЧЕННАЯ (СОКРАЩЕННАЯ) ЦЕПЬ
3) МАКСИМАЛЬНО УКОРОЧЕННАЯ (МАКСИМАЛЬНО СОКРАЩЕННАЯ) ЦЕПЬ.
Сначала разберем их строение на примере главной дыхательной цепи.
I. ГЛАВНАЯ ДЫХАТЕЛЬНАЯ ЦЕПЬ
Главная дыхательная цепь - это три мультиферментных комплекса, встроенных во внутреннюю мембрану митохондрии. Обозначаются они латинскими цифрами – I, III и IV.
СХЕМА ГЛАВНОЙ (ПОЛНОЙ) ДЫХАТЕЛЬНОЙ ЦЕПИ
МИТОХОНДРИАЛЬНОГО ОКИСЛЕНИЯ

Комплекс I – НАДН-KoQ-редуктаза, комплекс III – KoQH2-редуктаза, комплекс IV – цитохромоксидаза. Есть еще комплекс II – сукцинат-KoQ-редуктаза, но он существует отдельно от остальных комплексов и не входит в состав главной цепи.
Эти комплексы транспортируют водород от никотинамидных дегидрогеназ на кислород воздуха, в результате чего создается электрохимический градиент концентраций протонов - DmH+. Он возникает на внутренней мембране митохондрий между матриксом и межмембранным пространством. Его составляют два основных фактора:
1) Электрический мембранный потенциал Dy.
2) Градиент pH (осмотический или химический градиент).
DmH+=Dy-k×DpH
DmH+ - положительная величина. Его можно выразить как в вольтах (V), так и в единицах энергии (кДж/моль). Изменение значения pH на одну единицу соответствует 0,06V или 5,7 кДж/моль.
Энергия DmH+ используется для следующих процессов:
Синтез АТФ.
2) Получение тепла(особенно важно для бурого жира и для мышечной ткани птиц).
3) Выполнение осмотической работы(транспорт фосфата в матрикс митохондрии).
4) Мышечная работа(в некоторых случаях).
Для человека наиболее важен синтез АТФ.
В полной цепи при окислении субстрата два атома водорода переносятся на НАД – кофермент никотинамидных дегидрогеназ.
Как видно из приведенной схемы, в полной цепи при передаче двух атомов водорода на кислород воздуха, в межмембранном пространстве оказываются 10 протонов, перенесенных сюда из матрикса.
Все переносчики встроены во внутреннюю мембрану митохондрий, кроме никотинамидных дегидрогенказ. Они составляют дыхательный ансамбль, тысячи таких ансамблей существуют в митохондрии и потребляют 90-95% кислорода, который используется клеткой. Два атома водорода отнимаются от субстрата и передаются на О2 с образованием Н2О. Разность потенциалов на двух концах полной цепи составляет 1.14V.
НИКОТИНАМИДНЫЕ ДЕГИДРОГЕНАЗЫ (НАДГ)
Небелковая часть этих ферментов представляет собой динуклеотид: НИКОТИНАМИД-АДЕНИНДИНУКЛЕОТИД (НАД+) или НИКОТИНАМИДАДЕНИНДИНУКЛЕОТИДФОСФАТ (НАДФ+).

Студенты обязаны знать формулу НАД(Ф) и механизм присоединения к нему водорода. НАД(Ф) содержит производное витамина РР - никотинамид. (см. раздел «Витамины»).
НАД+ и НАДФ+ входят в состав каталитического центра НАДГ. Они являются КОФЕРМЕНТАМИ, так как связаны с белковой частью слабыми типами связей - могут легко диссоциировать. Они присоединяются к белковой части только в момент протекания реакции. Реакция, которую катализируют НАДГ - это реакция окисления субстрата.

Известно около 150 НАДГ, которые различаются по строению белковой части (апофермента).
Апоферменты большей части НАДГ способны присоединять или только НАД, или только НАДФ, и лишь немногие способны соединяться и с тем, и с другим коферментами. НАДГ, участвующие в митохондриальном окислении, находятся в матриксе митохондрий, в отличие от большинства других участников дыхательной цепи, которые встроены во внутреннюю мембрану. НАДГ можно встретить и в цитоплазме клеток. Мембрана митохондрий непроницаема для НАД(Ф), поэтому митохондриальный и цитоплазматический НАД(Ф) никогда не смешиваются. В митохондриях содержится очень много НАД и почти нет НАДФ, а в цитоплазме - наоборот - очень много НАДФ и почти нет НАД.
Из матрикса митохондриальный НАД×Н2 отдает два атома водорода на «комплекс I», встроенный во внутреннюю мембрану митохондрий.
КОМПЛЕКС I
В составе комплекса находится 26 полипептидных цепей общей массой 800 кДа. Комплекс содержит следующие небелковые компоненты: Флавинмононуклеотид (ФМН), 5 центров FeS (железо-серные центры): FeS1a, FeS1b FeS2, FeS3, FeS4.
В транспорте водорода по дыхательной цепи в этом комплексе принимает участие ФМН.


Одновременно с протонами транспортируются и электроны. Наибольшие перепады редокс-потенциала наблюдаются между железо-серными белками, расположенными в следующем порядке:
ФМНÞFeS1aÞFeS1bÞFeS3ÞFeS4ÞFeS2
Комплекс I – интегральный белковый комплекс. Используя энергию, выделяющуюся при переносе электронов по дыхательной цепи, он транспортирует 4 протона из матрикса в межмембранное пространство – комплекс I работает как протонный генератор. Точный механизм этого транспорта до сих пор неизвестен.
Далее комплекс I восстанавливает промежуточный переносчик KoQ (убихинон).

Это жирорастворимое низкомолекулярное вещество, содержащее длинную изопреновую цепь, не имеет белковой части. КоQ принимает водород от комплекса I. Образовавшийся КоQH2 отдает водород на комплекс III.
КОМПЛЕКС III.
В своем составе содержит цитохромы – сложные белки, содержащие небелковый компонент - простетическую группу, сходню по строению с небелковой частью гемоглобина – гемом.
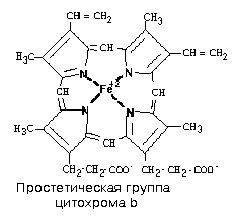
1) Цитохромы b, имеющие в своем составе два типа простетических групп тетрапиррольной структуры - «гем». Известно два гема цитохромов: be, обладающий низким окислительно-восстановительным потенциалом и bh с высоким окислительно-восстановительным потенциалом. Строение простетической группы цитохромов группы b, похожей на гем белка гемоглобина, представлено на рисунке. Его необходимо выучить.
 2)FeSIII – железо-серный кластер.
2)FeSIII – железо-серный кластер.
3) Цитохром С1. Имеет в своем составе особый гем типа «с».
Друг от друга цитохромы могут отличаться:
1) Строением белковой части;
2) Значением окислительно-восстановительного потенциала;
3) Строением радикалов, расположенных по периферии гема;
4) Присоединением гема к белковой части – в некоторых случаях гем присоединен к ней ковалентной связью за счет радикалов цистеина, что характерно для цитохромов c1 и c.
От двух атомов водорода, которые переносятся на комплекс III от KoQ, дальше по цепи транспортируются только электроны, два протона (H+)комплекс III выбрасывает в межмембранное пространство вместе с еще одной парой протонов, которые подхватываются комплексом из матрикса. Таким образом, комплекс III в сумме выбрасывает в межмембранное пространство 4 протона. Поэтому комплекс III, как и комплекс I, является протонным генератором, и целью его работы также является создание DmH+.
КОМПЛЕКС IV.
Комплекс IV называется цитохромоксидазой. Он способен захватывать из матрикса 4 протона. Два из них он отправляет в межмембранное пространство, а остальные передает на образование воды.
Благодаря многоступенчатой передаче энергия в дыхательной цепи выделяется не мгновенно, а постепенно (маленькими порциями) при каждой реакции переноса. Эти порции энергии не одинаковы по величине. Их величина определяется разницей между ОВП двух соседних переносчиков. Если эта разница небольшая, то энергии выделяется мало - она рассеивается в виде тепла. Но на нескольких стадиях ее достаточно, чтобы синтезировать макроэргические связи в молекуле АТФ. Такими стадиями являются:
1) НАД/ФАД - разность потенциалов 0.25V.
2) Цитохромы b/cc1 - 0.18V
3) aa3/O-2 - 0.53V.
Значит, на каждую пару атомов водорода, отнятых от субстрата, возможен синтез 3-х молекул АТФ.
 АДФ + Ф + ЭНЕРГИЯ -------> АТФ + Н2О
АДФ + Ф + ЭНЕРГИЯ -------> АТФ + Н2О
Макроэргическая связь - это такая ковалентная связь, при гидролизе которой выделяется не менее 30 кДж/моль энергии. Эта связь обозначается знаком ~.
Синтез АТФ за счет энергии, которая выделяется в системе МтО, называется ОКИСЛИТЕЛЬНЫМ ФОСФОРИЛИРОВАНИЕМ. Основная роль АТФ - обеспечение энергией процесса синтеза АТФ.
Для оценки эффективности работы системы МтО при окислении вычисляют КОЭФФИЦИЕНТ P/O. Он показывает, сколько молекул неорганического фосфата присоединилось к АДФ в расчете на один атом кислорода.
Для главной (полная) цепи Р/О=3 (10H+/2H+(затраты на освобождение АТФ из комплекса с ферментом) + 1H+ (затраты на транспорт фосфата)) = 3,3 (округляют до 3-х)), коэффициент полезного действия системы - 65%, для укороченной P/O=2 (6H+/2H+(затраты на освобождение АТФ из комплекса с ферментом) + 1H+ (затраты на транспорт фосфата)) = 2, для максимально укороченнойP/O=1 (4H+/2H+(затраты на освобождение АТФ из комплекса с ферментом) + 1H+ (затраты на транспорт фосфата)) = 1.
Система МтО потребляет 90% кислорода, поступающего в клетку. При этом в сутки образуется 62 килограмма АТФ. Но в клетках организма содержится всего 20-30 граммов АТФ. Поэтому молекула АТФ в сутки гидролизуется и снова синтезируется в среднем 2500 раз (средняя продолжительность жизни молекулы АТФ - полминуты).
ОСНОВНЫЕ ПРОЦЕССЫ, ДЛЯ КОТОРЫХ ИСПОЛЬЗУЕТСЯ ЭНЕРГИЯ АТФ:
1. Синтез различных веществ.
2. Активный транспорт (транспорт веществ через мембрану против градиента их концентраций). 30% от общего количества расходуемого АТФ приходится на Na+,К+-АТФазу.
3. Механическое движение (мышечная работа).
СИНТЕЗ АТФ.
Во внутренней мембране митохондрий расположен интегральный белковый комплекс – Н+-зависимая АТФ-синтаза seu Н+-зависимая АТФ-аза(два разных названия связаны с полной обратимостью катализируемой реакции), обладающий значительной молекулярной массой – более, чем 500кДа. Состоит из двух субъединиц: FO и F1.
F1 представляет из себя грибовидный вырост на матриксной поверхности внутренней митохондриальной мембраны, FO же пронизывает эту мембрану насквозь. В толще FO расположен протонный канал, позволяющий протонам возвращаться обратно в матрикс по градиенту их концентраций.
F1 способна связывать АДФ и фосфат на своей поверхности с образованием АТФ - без затраты энергии, но обязательно в комплексе с ферментом. Энергия необходима лишь для освобождения АТФ из этого комплекса. Эта энергия выделяется в результате тока протонов через протонный канал FO.
В дыхательной цепи сопряжение абсолютно: ни одно вещество не может окисляться без восстановления другого вещества.
Но при синтезе АТФ сопряжение одностороннее: окисление может идти без фосфорилирования, а фосфорилирование без окисления никогда не идёт. Это означает, что система МтО может работать без синтеза АТФ, но АТФ не может быть синтезирована, если не работает система МтО.
|
© 2013 wikipage.com.ua - Дякуємо за посилання на wikipage.com.ua | Контакти |