
некоторых металлов (ряд напряжений)
|
|
| Уравнение электродного процесса | Стандартный потенциал (   ) при ) при   . .
| Уравнение электродного процесса | Стандартный потенциал (   ) при ) при   . .
|
| Li++e-=Li | -3,045 | Co2++2e-=Co | -0,277 |
| Rb++e-=Rb | -2,925 | Ni2++2e-=Ni | -0,250 |
| K++e-=K | -2,925 | Sn2++2e-=Sn | -0,136 |
| Cs++e-=Rb | -2,923 | Pb2++2e-=Pb | -0,126 |
| Ca2++2e-=Ca | -2,866 | Fe3++3e-=Fe | -0,036 |
| Na++e-=Na | -2,714 | 2H++2e-=H2 | |
| Mg2++2e-=Mg | -2,363 | Bi3++3e-=Bi | 0,215 |
| Al3++3e-=Al | -1,662 | Cu2++2e-=Cu | 0,337 |
| Ti2++2e-=Ti | -1,628 | Cu++e-=Cu | 0,521 |
| Mn2++2e-=Mn | -1,180 | Hg22++2e-=2Hg | 0,788 |
| Cr2++2e-=Cr | -0,913 | Ag++e-=Ag | 0,799 |
| Zn2++2e-=Zn | -0,763 | Hg2++2e-=Hg | 0,854 |
| Уравнение электродного процесса | Стандартный потенциал (   ) при ) при   . .
| Уравнение электродного процесса | Стандартный потенциал (   ) при ) при   . .
|
| Cr3++3e-=Cr | -0,744 | Pt2++2e-=Pt | 1,2 |
| Fe2++2e-=Fe | -0,440 | Au3++3e-=Au | 1,498 |
| Cd2++2e-=Cd | -0,403 | Au++e-=Au | 1,691 |
Таблица 7. Растворимость кислот, солей, оснований в воде.
| Ионы | OH 
| NO 
| F 
| Cl 
| Br 
| I 
| S 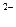
| SO 
| SO 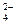
| CO 
| SiO 
| PO 
| CH  COO COO 
|
H 
| P | P | P | P | P | P | P | P | P | H | P | P | |
NH 
| P | P | P | P | P | P | P | P | P | P | - | P | P |
Li 
| P | P | P | P | P | P | P | P | P | P | P | H | P |
K 
| P | P | P | P | P | P | P | P | P | P | P | P | P |
Na 
| P | P | P | P | P | P | P | P | P | P | P | P | P |
Ag 
| - | P | P | H | H | H | H | M | M | H | H | H | P |
Ba 
| P | P | M | P | P | P | - | M | H | H | H | H | P |
Ca 
| M | P | H | P | P | P | - | M | M | H | H | H | P |
Ni 
| H | P | P | P | P | P | H | H | P | - | H | H | P |
Sn 
| H | P | P | P | P | P | H | - | P | - | - | H | P |
Pb 
| H | P | M | M | M | H | H | H | H | H | H | H | P |
Cu 
| H | P | P | P | P | - | H | - | P | - | - | H | P |
Hg 
| - | P | - | P | M | H | H | - | P | - | - | H | P |
Hg 
| - | - | M | H | H | H | H | - | M | H | - | H | M |
Fe 
| H | P | M | P | P | P | H | M | P | H | H | H | P |
Fe 
| H | P | H | P | P | - | H | - | P | - | - | H | P |
Al 
| H | P | M | P | P | P | - | - | P | - | - | H | P |
Cr 
| H | P | M | P | P | P | - | - | P | - | - | H | P |
Mg 
| M | P | M | P | P | P | - | M | P | H | H | H | P |
| Zn2+ | H | P | M | P | P | P | H | M | P | H | H | H | P |
Таблица 8. Степени окисления s- и р- элементов.
| Группа | I | II | III | IV | V | VI | VII | VIII |
| s-элементы | р-элементы | |||||||
| Валентные электроны | s1 | s2 | s2р1 | s2р2 | s2р3 | s2р4 | s2р5 | s2р6 |
| Элемент Степени окисления | Li | Be | B | C 4,2 -4 | N 5,3 -3 | O -2 | F - -1 | Ne - - |
| Элемент Степени окисления | Na | Mg | Al | Si 4,2 -4 | P 5,3 -3 | S 6,4 -2 | Cl 1,3,5,7 -1 | Ar - - |
| Элемент Степени окисления | K | Ca | Ga | Ge 4,2 -4 | As 5,3 -3 | Se 6,4 -2 | Br 1,3,5,7 -1 | Kr 2,4 - |
| Элемент Степени окисления | Rb | Sr | In | Sn 4,2 -4 | Sb 5,3 -3 | Te 6,4 -2 | I 1,3,5,7 -1 | Xe 2,4,6,8 - |
| Элемент Степени окисления | Cs | Ba | Tl 1,3 | Pb 2,4 -4 | Bi 3,5 -3 | Po 4,6 -2 | At 5,7 -1 | Rn (2,4,6,8) - |
Серым выделены символы неметаллов
Таблица 9. Основные классы неорганических веществ.
| Вещества | Классификация | Примеры | |
| Простые | Металлы | s–элементы (кроме Н, Не) р–элементы Al, Ga, In, Tl, Ge, Sn, Pb, Sb, Bi d–элементы f–элементы | |
| Неметаллы | s–элементы Н, Не р–элементы B, C, Si, N, P, As, O, S, Se, Te галогены (VII A группа) благородные газы (VIII A группа) | ||
| Сложные | Бинарные соединения | гидриды карбиды нитриды оксиды сульфиды галиды | LiH, NaH, CaH2, AlH3 Be2C, CaC2, Al4C3 Na3N, Mg3N2, Si3N4 Na2O, CaO, Al2O3, SO3 K2S, ZnS, Fe2S3 NaCl, BaCl2, FeCl3 |
| Вещества | Классификация | Примеры | |
| Сложные | Гидроксиды | кислоты основания амфолиты (амфотерные) | HNO3, H2SO4, H3PO4 KOH, Ba(OH)2, Ni(OH)3 Э(ОН)n = Н nЭОn Форма основания: Zn(OH)2, Al(OH)3, Be(OH)2 Форма кислоты: H2ZnO2, H3AlO3, H2BeO2 |
| Соли | средние кислые основные | NaNO3, Al2(SO4)3, K3PO4, KCl NaHSO4, KH2PO4, Ca(HCO3)2 MgOHCl, (CuOH)2SO4, Fe(OH)2Cl |
Таблица 10. Взаимосвязь простых веществ, оксидов,
оснований и кислот (реакции солеобразования)
| металл + кислота → соль + водород | 
|
| металл + неметалл → соль | 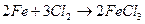
|
| металл (1) + соль (1) → соль (2) + металл (1) | 
|
| основный оксид + кислотный оксид → соль | 
|
| основный оксид + кислота → соль + вода | 
|
| основание + кислота → соль + вода (реакция нейтрализации) | 
|
| основание + кислотный оксид → соль + вода | 
|
| основание(1)+соль(1)→основание (2) + соль(2) | 
|
| соль(1) + кислота(1) → соль(2) + кислота(2) | 
|
| соль(1) + соль(2) → соль(3) + соль(4) | 
|
Амфотерные соединения могут проявлять и кислотные и основные свойства в зависимости от того, с чем реагируют:
 
|
Таблица 11. Периодическая система элементов Д.И. Менделеева.

СПИСОК ЛИТЕРАТУРЫ
1. Артеменко А.И.«Органическая химия». – М.: Высшая школа, 2000. – 559с.
2. Васильева З.Г., Грановская А.А., Таперова А.А. Лабораторные работы по общей и неорганической химии. – М.: Химия, 1979.
3. Введение в общую химию/Под ред. Г.П. Лучинского. – М.: Высшая школа, 1980.
4. Гельфман М.И., Ковалевич О.В., Юстратов В.П. Коллоидная химия.- СПб.: Издательство «Лань», 2003. – 336 с., ил. – (Учебник для вузов)
5. Глинка Н.Л. Задачи и упражнения по общей химии. – Л.: Химия, 2000.
6. Глинка Н.Л. Общая химия. – Л.: Химия, 2004.
7. Гольбрайх З.Е. Сборник задач и упражнений по химии. – М.: Высшая школа, 2001.
8. Картушинская А.И., Лельчук Х.А., Стромберг А.Г., Сборник задач по химической термодинамике.-М.: Высшая школа, 1973.
9. Коровин Н.В. Общая химия: Учеб. для технических направ. и спец. вузов. – М.: Высшая школа, 2005. – 557 с.
10. Краткий справочник физико-химических величин под редакцией А.А Равделя А.А., Пономаревой А.М.-Л.: Химия, 1986.
11. Курс общей химии/ Под ред. Н.В. Коровина. – М.: Высшая школа, 1981.
12. Курс химии. Ч. 2, специальная для строительных вузов/ Под. Ред. В.А. Киреева. – М.: Высшая школа, 1974.
13. Левант Г.Е., Райцин Г.А. Практикум по общей химии. – М.: высшая школа, 1978.
14. Лучинский Г.П. Курс химии. – М.: Высшая школа, 1985.
15. Павлов Н.Н. Теоретические основы общей химии. – М.: Высшая школа, 1978.
16. Романцева Л. М., Лещинская З. Л., Суханова В. А. Сборник задач и упражнений по общей химии: Учебное пособие для нехим. спец. вузов/ – М.: Высшая школа, 1991.-288 с.
17. Семчиков Ю.Д. Высокомолекулярные соединения. – М.: Издательский центр «Академия», 2003. – 368 с.
18. Тугов И.И., Костыкина Г.И.«Химия и физика полимеров». – М.: Химия, 1989. – 432с.
19. Фролов В.В. Химия. – М.: Высшая школа, 1979.
20. Харин А.Н., Катаева Н.А., Харина Л.Т. Курс химии. – М.: Высшая школа, 1983.
21. «Энциклопедия полимеров» гл. ред. В.А. Каргин. – М.: Советская энциклопедия, 1972. 1-3 том.
СОДЕРЖАНИЕ
КАФЕДРА ОБЩЕЙ И СПЕЦИАЛЬНОЙ ХИМИИ.. 3
ОБЩИЕ МЕТОДИЧЕСКИЕ УКАЗАНИЯ.. 3
ПРОГРАММА.. 5
КОНТРОЛЬНЫЕ ЗАДАНИЯ.. 12
1. Задания к контрольной работе №1. 12
1.1.Моль. Эквиваленты и мольные массы эквивалентов простых и сложных веществ. Закон эквивалентов. 12
1.2. Энергетика химических процессов. 18
(термохимические расчеты) 18
1.3. Химическое сродство. 23
1.4. Химическая кинетика. 28
1.5. Химическое равновесие. 33
1.6.Способы выражения концентрации раствора. 39
1.7. Свойства растворов. 46
1.8. Ионно – молекулярные (ионные) реакции обмена. 51
1.9. Гидролиз солей. 57
2. Задания к контрольной работе №2. 63
2.1. Окислительно – восстановительные реакции. 63
2.2. Электродные потенциалы и электродвижущие силы.. 73
2.3. Коррозия металлов. 84
2.4. Электролиз. 89
2.5. Свойства соединений s-, p-, d – элементов. 96
2.6. Жесткость воды и методы её устранения. 102
2.7. Органические соединения. Полимеры. 106
2.8. Дисперсные системы. 111
ТАБЛИЦА ВАРИАНТОВ КОНТРОЛЬНЫХ ЗАДАНИЙ.. 117
ПРИЛОЖЕНИЕ.. 124
СПИСОК ЛИТЕРАТУРЫ... 132
|
© 2013 wikipage.com.ua - Дякуємо за посилання на wikipage.com.ua | Контакти |