
Еквівалент в кислотно-основних реакціях
|
|
Еквівалент кислоти або основи – це така реальна або умовна частинка даної речовини, яка в даній кислотно-основній реакції звільняє один гідроген – йон або сполучається з ним, або якимось- небудь іншим способом еквівалента йому. Еквівалент – величина безрозмірна. Одиницею кількості еквівалентів є моль. Еквівалент речовини змінний і залежить від реакції в якій ця речовина приймає участь. Наприклад, стехіометрія реакції кальцій гідроксиду і хлоридної кислоти передається рівнянням
Са(ОН)2 + НСl = СаОНСl + Н2О /1/
Отже, одна молекула кальцій гідроксиду взаємодіє з однією молекулою хлоридної кислоти, тобто з одним гідроген-йоном. За таких умов при взаємодії об’єми розчинів калій гідроксиду і хлоридної кислоти будуть рівні V/Ca(ОН)2/ = V(HCl) тоді, коли будуть рівні їх концентрації С/Са (ОН)2/ = С(HCl) і кількості реагуючих речовин  .
.
Число, яке показує, яка частка реальної частинки речовини (Х) еквівалентна одному гідроген-йону в даній кислотно-основній реакції, називається фактором еквівалентності речовини (Х). Фактор еквівалентності – величина безрозмірна. В загальному вигляді фактор еквівалентності речовини (Х) позначається символом
f екв. (Х), а форма запису еквівалента речовини (Х) має слідуючий вигляд: f екв. /Х/Х. в реакції /1/ фактор еквівалентності кальцій гідроксиду дорівнює 1: f екв. /Са (ОН)2/= 1, а форма запису еквівалента – f екв. /Са(ОН)2/ СА(ОН)2 = Са(ОН)2. отже, величина f екв. / Са(ОН)2/ СА(ОН)2 називається еквівалентом кальцій гідроксиду і є безрозмірною величиною.
Якщо реакція кальцій гідроксиду і хлоридної кислоти проходить за рівнянням
Са(ОН)2 +2 НСl = СаСl2 + 2Н2О /2/
1 молекула 2 молекули
½ молекули 1 молекула
то на кожну реагуючу частинку кальцій гідроксиду, тобто на одну молекулу гідроксиду припадає 2 реагуючі реальні частинки хлоридної кислоти (2 молекули НСl). Або на одну реагуючу реальну частинку хлоридної кислоти, тобто на один гідроген-йон припадає ½ реальної частинки кальцій гідроксиду.
½ Са(ОН)2 + НСl = ½ СаСl2 + Н2О /2а/
Із рівняння /2а/ добре видно умовні частинки. В даному випадку умовні частинки – це півмолекули кальцій гідроксиду /1/2 Са(ОН)2/ чи пів молекули кальцій хлориду /1/2 СаCl2/.
Звідси виходить, що умовні частинки – це частки реальних частинок (молекул, атомів, йонів) чи їх груп.
В реакції /2/ чи /2а/ фактор еквівалентності кальцій гідроксиду дорівнює ½: f екв. /Са(ОН)2/ =1/2 . таким чином, фактор еквівалентності речовини розраховують на основі стехіометрії реакції. Ось чому треба вказувати рівняння реакції з участю цієї речовини. В умовах стехіометрії реакції /2а/ об’єми розчинів кальцій гідроксиду і хлоридної кислоти будуть рівні тоді, коли будуть рівні їх концентрації /с(1/2 Са (ОН)2)= с (НСl)/ і кількості реагуючих речовин / 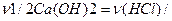 . Форма запису еквівалента кальцій гідроксиду для реакції /2/чи /2а/ має вигляд:
. Форма запису еквівалента кальцій гідроксиду для реакції /2/чи /2а/ має вигляд:
f екв./Са(ОН)2 /Са(ОН)2= ½ СА(ОН)2
Отже, фактор еквівалентності речовини в кислотно-основних реакціях може бути рівний або менший одиниці. Знаменник фактора еквівалентності не називають числом еквівалентності.
Молярна маса еквівалента речовини (Х) – це маса одного моля еквівалента цієї речовини рівна добутку фактора еквівалентності на молярну масу цієї речовини (Х). Молярна маса еквівалента речовини (Х) має форму запису М /f екв. /Х/Х/ і обчислюється за формулою
М/f екв. /Х/Х/ = f екв. /Х/ ∙ М /Х/
Молярна маса еквівалента кальцій гідроксиду для реакції /1/ має таке позначення і величину:
М/f екв. /Са(ОН)2/ Са(ОН)2/ = f екв./Са(ОН)2 М(Са(ОН)2)
М/Са(ОН)2/= 1 М/Са(ОН)2/
М/Са(ОН)2/= 1∙74 г/моль
М/Са(ОН)2/= 74 г/моль
Для реакції /2/ чи /2а/ молярна маса еквівалентна кальцій гідроксиду має таку форму запису і величини:
М/f екв./Са(ОН)2/ Са(ОН)2/= f екв. /Са(ОН)2 ∙ М Са((ОН)2)
М/1/2 Са(ОН)2/ = ½ ∙ М (Са(ОН)2)
М/1/2 Са(ОН)2/ = ½ ∙ 74 г/моль
М/1/2 Са(ОН)2/ = 37 г/моль
Кількість речовини еквівалента – це кількість речовини (в молях), в якій частинками є еквіваленти. Загальна форма запису кількості речовини еквівалентів така:
ν/f екв./Х/Х/
Наприклад, кількість речовини еквівалента кальцій гідроксиду ν/fекв/Са(ОН)2/Са(ОН)2/, ν/Са(ОН)2/ =1 моль в кислотно-основній реакції /2/ /2а/ або ν/fекв/Са(ОН)2/Са(ОН)2/, ν/1/Са(ОН)2/ =1 моль в кислотно-основній реакції /2/ чи /2а/.
Молярна концентрація еквівалента (нормальність) – це відношення кількості речовини еквівалента в розчині (в системі) до об’єму цього розчину (об’єму цієї системи).
Молярна концентрація має таку загальну форму запису:
 | моль/л, моль/дм3, моль/м3
| моль/л, моль/дм3, моль/м3
Розчин з молярною концентрацією еквівалентів речовини рівного 1 моль/л називається однонормальним. Розчин, що містить в 1 л 0,1 моль еквівалента називається децинормальним, 0,01 моль/л – сантинормальним, 0,001 моль/л – мілінормальним.
|
© 2013 wikipage.com.ua - Дякуємо за посилання на wikipage.com.ua | Контакти |